新藥
」 台股 新藥股 健保 新藥 生技
今年健保藥價砍36.15億「調幅創新低」!影響2343藥品 4/1上路
近年來因人口老化迅速、平均餘命增加及新藥引進,台灣健保藥費逐年成長,衛福部健保署為控制支出,自102年起試辦相關方案來調整藥價。而健保署25日公布今年(115年)藥價調整結果,此次藥價調整金額為36.15億元,調整幅度為1.65%,調幅創13年最低,而調查的藥品有1萬2652項,未調整1萬1309項,調整2343項,調整項目數也是歷年最低,新藥價將於4月1日起開始實施。健保署指出,自102年起試辦藥品費用支出目標制(Drug Expenditure Target, DET),於總額預算下,當實際藥費支出超過年度藥費支出目標值,則依藥價調查結果,針對藥價差超過一定範圍者,於隔年啟動藥價調整。藥價調整時,衡酌需強化藥品供應韌性,維護醫療服務穩定,考量基本用藥項目需求、調降幅度頻次合理性及基本價保障等原則,以確保合理調整藥價及確保民眾用藥權益。健保署資料顯示,去年(114年)藥價調整金額砍48.51億元,今年僅36.15億元,調幅從去年的2.3%降至1.65%,且今年只調整了2343項藥品,其中調降2245項、調升98項,同樣比去年共3184項還少,至於藥價調整後節省的36.15億元,將回歸健保總額運用。健保署醫審及藥材組長黃育文表示,因應國際匯率、美國關稅及原物料上漲等因素,加上國內外藥廠生產線調整,為確保臨床上供藥穩定及國家藥物韌性,只要是食藥署公告的必要藥品,如抗生素、胰島素等品項,均未調整。健保署強調,藥價調整是依全民健康保險法第46條規定辦理,為每年例行作業,廠商對於調整後藥價,認為有不敷成本情況,均可於公告日起兩週內檢具成本分析資料,依全民健康保險藥物給付項目及支付標準第34條規定,向健保署建議提高藥品價格。

「15%不是勝利,而是沉重代價」 國民黨:食安防線鬆動與勞工、農民權益長期隱憂
針對政府公布台美經貿協定相關內容,中國國民黨今(13)日表示,這次協定表面上談的是關稅,但實際上牽動的是攸關食安民生以及勞工權益的問題。國民黨將會在國會啟動嚴格的監督機制,嚴格把關相關法規與執行細節,確保國人餐桌安全與孩子校園飲食健康不被犧牲,堅決保障受台美貿易協定衝擊重創而失業的勞工權益。國民黨認為,這份協議並非政府所宣稱的「重大突破」,而是一項可能讓民眾在不知情下承擔風險的安排。這不僅是經貿問題,更關乎每個家庭的餐桌安全與生活品質。政府卻急於將其包裝為外交與經貿成果,對可能衍生的食安疑慮與長期衝擊說明不足。國民黨立法院黨團將啟動專案監督機制,嚴格把關相關法規與執行細節,確保國人餐桌安全與孩子校園飲食健康不被犧牲。國民黨並要求,應關注受台美貿易協定衝擊而可能失業的勞工權益,尤其是汽車及零組件業、農業與畜產、屠宰業、醫療保健業等相關產業。對受影響的勞工,應提供專款專用的轉職訓練津貼,以及培訓期間的生活費,確保其在職業轉型過程中不致陷入困境。此外,當台美貿易協定導致美國肉類(如豬肉、牛肉、雞肉)大量進口,造成國內農產品價格下跌或農民收益減少時,農民即可申請該基金的補助,作為緩衝與救助措施,保障國內農牧業的基本生計。國民黨強調,保障勞工與農民利益,必須與經貿開放同步推行,避免貿易協定造成產業、勞動與民生的二次傷害。此外,國民黨並提出十項重大疑慮,要求行政部門逐一說清楚、講明白。國民黨質疑,一、「醫療主權大讓步 食藥署審查權是否遭架空?」協定條文若明確載明我方接受美國主管機關對醫療器材與藥品的上市許可,且不得「額外要求」,等同限縮我國衛福部食藥署(TFDA)的獨立技術審查空間。國民黨質疑,未來高風險醫材與新藥是否仍須經過本土臨床數據評估?是否仍保有補充試驗與風險管理的裁量權?一旦發生不良反應,責任歸屬與藥害救濟機制如何處理?國民黨要求衛福部明確說明:是否涉及修訂相關審查辦法與技術指引?是否須送立法院審議?台灣醫療監管主權不能因貿易談判而被弱化。國民黨再指,二、「農產品「非關稅障礙」全撤?萊豬萊牛與查廠機制恐受衝擊」,協定若承諾提供美方「優惠市場准入」並處理所謂「非關稅障礙」,外界合理關切,是否涉及萊克多巴胺殘留標準、原產地標示規範及邊境查驗強度。國民黨質疑,若不得再對美方已列冊肉品工廠進行個別查廠,是否形同放寬把關?校園午餐是否仍可維持現行禁用政策?基層豬農與肉牛養殖戶將面臨何種價格衝擊?國民黨要求農業部與衛福部公開所有執行細節與科學依據,相關審查辦法是否修訂、是否送立法院審查,都必須向國人交代。三、「444億美元化石能源採購 淨零路徑是否倒退?」國民黨指出,協定附件揭露對美液化天然氣與原油長期採購承諾,金額龐大。此舉是否與2050淨零排放目標產生政策矛盾?是否排擠再生能源與低碳技術投資?在全球邁向減碳與碳邊境調整機制的趨勢下,政府若簽署多年高碳排能源採購承諾,是否將增加未來產業碳成本壓力?國民黨強調,立法院將嚴格審查環境影響與財務負擔,確保能源政策與減碳承諾不被經貿安排牽著走。國民黨表示,四、「健保核價制度恐受挑戰 全民藥費誰來埋單?」,協定強調法規透明與程序公平,但美方長期質疑台灣健保藥價制度。外界合理懷疑,是否涉及放寬原廠藥核價條件或限縮健保署調整藥價的權限。若因此導致健保支出上升、保費調漲,最終買單的是全體國人。國民黨要求政府明確承諾,現行藥價基準與調整機制不因協定而動搖。五、「化妝品與化學品標準調和 預防原則是否退讓?」,國民黨指出,美國對化妝品與工業化學品多採上市後管理模式,與台灣及歐盟強調預防原則的制度不同。若推動標準調和,是否意味我方須接受較寬鬆標準?若涉及禁限用成分鬆綁,相關科學依據為何?是否修訂現行法規?國民黨要求主管機關嚴守安全底線。六、「食品添加物與技術性貿易障礙條款 食安標準是否被迫調整?」,國民黨表示,協定若要求符合「國際標準」並承認美方合格評鑑程序,是否影響我國對人工色素、防腐劑及瘦肉精等物質的管理?國民黨強調,食安標準必須以國人健康為核心,而非為貿易便利而讓步。國民黨指出,七、「基改食品標示與校園禁令 知情權是否受限?」,若以「減少非關稅障礙」為由檢討基改食品標示制度,是否衝擊消費者知情權與校園午餐禁令?政府應公開承諾,現行基改食品強制標示與校園禁用規定不會退讓。八、「要求限期修法 立法自主權是否受干預?」國民黨表示,若協定明定我方須在一定期限內修改工會法相關條文,涉及立法權核心範圍。國民黨強調,任何修法都應由立法院依據國內產業與勞動現況審議,不容透過國際協定逕行指定內容與時程。九、「移工招聘費轉嫁雇主 產業成本是否劇增?」國民黨指出,若禁止向移工收取招聘費並改由雇主負擔,雖有其價值理念,但是否已評估對中小企業與漁業成本衝擊?政府是否有完整配套,避免成本轉嫁與產業震盪?國民黨質疑,十、「漁業勞檢標準受協定約束 行政權是否被外部化?」,若勞動檢查制度須符合協定條文規範,一旦遭認定未達標準,是否可能引發貿易制裁?國民黨強調,行政執法權與制度設計應由我國自主決定,不能在壓力下讓步。最後,國民黨表示,這份協定牽涉層面橫跨醫療、食安、能源、勞動與產業政策,已遠超單純關稅協商範疇。國民黨立法院黨團將持續透過質詢、專案報告、預算審查與公聽會等方式強化監督。國民黨強調,深化對外經貿往來固然重要,但國家主權、制度完整與人民健康安全更不容退讓。任何談判成果,都不能以犧牲台灣長期制度根基與食安防線為代價。

政府推動癌症防治計畫 賴清德:讓健康成為臺灣進步的重要力量
賴清德總統今(4)日上午以錄影方式為「2026世界癌症日」致詞表示,政府以「預防、篩檢、治療與照護」為主軸,推動國家癌症防治計畫,強化精準醫療,並編列預算確保癌症新藥基金永續運作,目標在2030年前將癌症標準化死亡率降低三分之一。期盼未來共同努力,讓健康成為臺灣進步的重要力量。賴清德表示,今天是世界癌症日,謝謝癌症希望基金會與高雄市政府共同舉辦「健康台灣、讓希望滾動全台」這麼有意義的活動,尤其基金會羅盛典副董事長以三天時間,透過自行車騎行超過四百公里,來提醒國人癌症防治的重要性,展現推動健康臺灣的決心,令人相當敬佩。賴清德指出,根據國際抗癌聯盟的統計,癌症是全球死因第2位,平均每年約有1千萬人死於癌症;在臺灣,癌症也連續43年蟬聯國人十大死因之首,這些數據都提醒我們,癌症的早期篩檢、即時治療與健康促進非常重要。賴清德提到,身為臺灣首位醫師出身的總統,我深刻理解,癌症對國人的健康照護與家庭經濟確實已形成巨大的壓力。因此定下目標,希望在2030年之前,達成癌症標準化死亡率降低三分之一的目標。賴清德續指,為了達成這個願景,政府以「預防、篩檢、治療與照護」為主軸,推動國家癌症防治計畫。去年的癌症篩檢經費,不但從前一年的28億元,大幅擴增為68億元,篩檢人次也因此較前一年新增106萬人次,總共累計536萬人次。賴清德說,政府也積極提升精準醫療的能力,透過基因檢測、精準診斷與跨部會合作,建立國際級資料庫,使臺灣與國際醫療標準接軌。此外,政府也推動「癌症新藥基金」,截至去年10月,我們已經收載20項新藥以及16項擴增給付,受惠人數達1萬2,300人,預估支付將近122億元。未來政府將持續編列預算,確保癌症新藥基金的永續運作。賴清德強調,防癌這條路,需要政府、民間、地方與國人共同努力。想對所有癌友與家屬說,你們並不孤單。政府會與醫療團隊、病友團體共同合作,讓國人健康、家庭美滿、國家更強。「我相信,只要我們團結努力,就能夠讓希望持續滾動,讓健康成為臺灣進步的重要力量」。

欠費逾88億會費不給 美國正式退出WHO
根據《美聯社》報導,美國聯邦官員23日證實,美國已完成退出世界衛生組織(WHO)的程序,此舉距離總統川普(Donald Trump)宣布終止美國與該組織78年合作關係,已經過去一年。然而,這場退出行動並非乾淨俐落。根據WHO資料,美國至今仍積欠約2.8億美元(約新台幣88.4億元)的會員費與捐款。儘管美國政府已完成正式退出程序,但仍未處理完包括未來如何取得其他國家疫情情報等關鍵問題,這些訊息對於防疫與疫苗研發至關重要。喬治城大學公共衛生法律專家高斯汀(Lawrence Gostin)批評此決定「是我一生中最具破壞性的總統決策」,並警告美國的退出將削弱全球對新疫情的應變能力,同時也限制美國科學家與藥廠在疫苗與新藥研發上的國際合作。世界衛生組織隸屬聯合國,是負責協調全球公共衛生威脅因應的專門機構,包括天花、伊波拉病毒、小兒麻痺等疫情的監控與支援。該組織也負責向開發中國家提供技術協助、疫苗與醫療資源,並針對心理健康與癌症等議題訂定全球指引。幾乎所有主權國家皆為WHO會員。美國歷來是WHO最大資助國之一,每年平均繳交約1.11億美元的會費,另有5.7億美元的自願性捐款,並派遣數百名具公共衛生專業人員參與WHO運作。川普於任內以WHO處理COVID-19疫情不當、未改革結構、過度受特定會員國政治干擾為由,簽署行政命令退出。白宮官員亦指出,自1948年WHO成立以來從未有美籍人士擔任秘書長,認為美國的貢獻未獲對等回報。不過專家警告,美國退出將嚴重衝擊全球疫病應對與預防工作,包括根除小兒麻痺、孕產婦健康、病毒新株監測等計畫。傳染病專家納哈斯醫師(Dr. Ronald Nahass)更直言此舉「短視且不負責任」。此外,美國已退出WHO各項技術小組與決策架構,包含流感株監測與疫苗更新建議小組,未來將失去即時疫情資訊來源,影響疫苗策略與準備。美國政府雖表示將透過雙邊合作直接取得資訊,但並未說明已有多少國家簽署類似協議。高斯汀質疑:「中國會單獨與美國簽這類合約嗎?美國對多國加徵關稅,那些國家會主動提供資料嗎?這說法幾近荒謬。」他亦指出,美國當初透過國會立法加入WHO,依法也應由國會決議退出,川普此舉恐涉越權。根據WHO,目前美國尚未繳交2024與2025年度費用,總欠款約2.8億美元。美國官員則否認有義務繳清退會前款項,雙方說法存在分歧。

抗過敏藥「停敏膜衣錠」不純物超標 急回收28萬顆
健保年用量超過1200萬錠的常見抗過敏藥物「停敏膜衣錠」傳出不純物超出檢驗規格上限,可能影響藥品品質與主成分含量。對此,衛福部食藥署已針對單一批號「E12161」、共28.3萬錠藥品啟動回收作業。根據健保申報資料,該藥品2024年使用量達1233萬2008錠,是常見的抗過敏處方用藥。不過根據食藥署公布的最新藥品回收資訊,此次回收藥品「美時停敏膜衣錠5毫克 DENOSIN FILM-COATED TABLETS 5MG "LOTUS")」,許可證字號為衛署藥製字第045972號,批號為「E1216」。食藥署說明,停敏膜衣錠為Desloratadine抗組織胺藥物,主要用於治療季節性過敏性鼻炎引起的相關症狀,以及緩解慢性原發性蕁麻疹相關症狀。此次回收的批號製造日期為2024年10月27日,效期2年,不純物總量上限為0.5%。食藥署提到,美時化學製藥股份有限公司於連續性安定性試驗中,發現總不純物含量超出檢驗規格上限,恐影響藥品品質與主成分含量;不純物主要來源自主成分隨時間降解所致,基於用藥品質與安全考量,決定全面回收該批號產品。食藥署表示,已要求廠商應於2月12日前完成回收作業,並應繳交回收成果報告書及後續預防矯正措施。若民眾有用藥影響,應儘速回診與醫師討論,處方其他適當藥品,請各醫療院所、藥商、藥局配合辦理回收作業,立即停止調劑、供應。

拒絕只做生技代工!「抗體之父」張子文博士 70 歲的二次創業夢
在台灣生醫領域,提到「張子文」這個名字,幾乎等同於一部鮮活的抗體發展史。從早年在清華、哈佛、MIT 的頂尖學術歷練,到在美國創立 Tanox 公司並研發出震撼世界的 Xolair 藥物,張子文博士始終站在科學的最前線。近日,在【生活講堂】節目中,主持人 Stacey 高葳 特別邀請到這位「台灣抗體之父」,一同探討他跨越半世紀的研發心路歷程,以及他對台灣生技產業未來發展的殷切期許。從學術巔峰到 Xolair 的全球傳奇張博士分享,他的研究生涯始於對免疫學的熱愛,在 MIT 進行博士後研究後,他進入了 J&J旗下的 Ortho 參與開發全球第一個抗體藥物。這段經歷開啟了他對抗體工程的想像,進而催生了他在美國的第一次創業——Tanox。當時,張博士發明了調控 IgE 的抗體技術,成功研發出治療重度哮喘與慢性蕁麻疹的重磅藥物 Xolair。這項成就不僅是學術上的突破,更是在商業上獲得巨大成功,至今仍是全球銷售領先的生物製劑。然而,對張博士而言,這只是他科學征途的第一站。70 歲的台灣夢:為家鄉創造世界級新藥許多人在 70 歲時選擇含飴弄孫,但張子文博士卻在 2014 年、從中研院退休前夕,決定再次投入創業,創辦了「免疫功坊 (Immunwork)」。「我自覺還有很多事情可以做,」張博士在專訪中坦言,「我希望能為台灣創造出世界級的新藥。」他指出,台灣過去的新藥開發往往在完成早期臨床試驗(Phase 1 或 Phase 2)後,就因為資金壓力或資源匱乏,急於將權利授權給國際大廠。張博士向 Stacey 形容,這種模式就像是生技界的「代工」:「我們做了最辛苦、風險最高的前段研發,但最後收穫果實的市場權利,卻在別人手上。如果你說要發展產業,卻不賣自己的藥,這算什麼發展產業呢?」借鏡半導體:台灣生技的突破關鍵在訪談中,張博士精確地分析了台灣生技與半導體產業的對比。他認為台灣並不缺人才,也不缺錢,缺的是像發展電子產業那樣的「魄力」與「懂行的人」。目前,免疫功坊運用獨步全球的「T-E 型藥物平台」與「脂肪酸束技術」,發展出多項具備長效特性的創新藥物。例如,針對調節代謝機能(如體重管理、肥胖症、糖尿病及脂肪肝相關領域)的候選藥物TE-8105,已經完成臨床第一/二A期試驗。張博士希望能透過這些有價值的專案,帶領台灣公司真正走向國際化,而不僅僅是受制於人的研發單位。「假如我們的藥物能成為世界級的新藥,那麼這家公司就會是世界級的公司,台灣也會被國際看見,」張博士信心十足地表示。主持人 Stacey 在訪談尾聲感性地提到,張博士的精神是許多年輕創業者的標竿。從一位科學家到一位堅持「品牌權利」的創業家,張子文正以他的行動證明,台灣具備與國際拚搏的技術實力。只要能突破資金與策略的侷限,2030 年台灣誕生世界級生技公司的夢想,或許並不遙遠。免疫功坊:https://www.immunwork.com/index.php?lang=tw

中國生物製藥全面挑戰美國主導地位!北京與上海恐成世界創新中心
中國生物製藥產業正站上關鍵轉折點。隨著研發實力與產業結構的成熟,這個全球第2大製藥市場已被視為進入「創新2.0」階段,從過往追求速度與規模的高速擴張,轉向以品質、價值與商業化能力為核心的發展模式。在部分關鍵領域,中國不僅已追上美國,甚至開始展現超車之勢。據《南華早報》報導,分析公司科睿唯安(Clarivate)於12月8日發布的報告指出,中國生物製藥產業正在經歷1場根本性的優先順序轉換,從資本驅動轉向價值導向,從追逐市場熱點轉向建立可持續競爭優勢。科睿唯安生命科學與醫療健康(Clarivate Life Sciences and Healthcare)資深顧問Alice Zeng指出,過去10年間,中國企業專注於如何進行研發,如今則必須正面迎接藥物上市後的現實問題,包括市場策略、定價能力與重磅藥物的打造。這種轉變發生之際,美國對中國生技能力的警戒也持續升高。美國國會多年來推動的《生物安全法案》(Biosecure Act),已於12月18日隨國防法案正式立法,授權行政部門限制與特定中國生物科技公司的聯邦合約往來。儘管法案未直接點名企業,但其長期影響,特別是在早期藥物研發與合作層面,仍被業界高度關注。然而,限制措施能否有效遏止中國的生物製藥崛起,正逐漸受到質疑。今年4月,美國兩黨立法委員會「新興生物科技國家安全委員會」(National Security Commission on Emerging Biotechnology)警告,美國僅剩3年時間維持或重奪生物科技領導地位,並於12月直言,美中差距縮小的速度「快於預期」。該委員會形容,1個以北京與上海取代舊金山與波士頓、成為全球生物製藥創新核心的世界,已不再只是想像。在實務層面,中國企業已在PD-1癌症藥物等領域展現競爭力。由上海君實生物(Shanghai Junshi Biosciences)研發的特瑞普利單抗(Toripalimab),於2023年獲美國食品藥物管理局(Food and Drug Administration,FDA)核准治療鼻咽癌,成為首款獲准對抗此類侵襲性癌症的藥物。即便在美國的售價遠高於中國,該藥仍比美國同類產品便宜約2成,突顯中國在成本與供應鏈上的優勢。數據同樣反映這股趨勢。2004年至2023年間,全球共推出942種新型活性物質,其中美國居首、中國緊隨其後。根據科睿唯安統計,中國已成為全球新分子實體(New molecular entity,NME)首次上市數量排名第2的國家,並在2024年占比達18%。在標靶蛋白質降解(targeted protein degradation,TPD)等前沿技術上,中國於論文發表、專利與研發管線的全球占比均居領先地位。支撐這一躍進的,還包括龐大的科研產出與政策配套。2024年,中國發表的生命科學論文占全球近3成,幾乎是9年前的2倍。官方推出的30天臨床試驗快速審批通道,以及串聯研發、融資、監管與健保的政策體系,進一步壓縮藥物上市時程,使中國的審批速度已與美國幾乎同步。這樣的環境,也吸引國際藥廠重新思考市場布局。越來越多企業選擇優先向中國國家藥品監督管理局(National Medical Products Administration,NMPA)申請上市,再進軍其他成熟市場。對於面臨激烈競爭與高成本壓力的企業而言,中國不僅是龐大的銷售市場,更可能成為全球化布局的起點。然而,低成本亦帶來結構性挑戰。Alice Zeng指出,中國來源藥物的價格優勢,正使印度、南韓等新興市場的競爭變得更加激烈,甚至可能壓縮全球創新生態的利潤空間。她警告,若創新藥物只能以最低價競爭,將難以支撐長期研發投資,反而削弱整體產業的可持續性。即便如此,多數觀察者認為,要在創新藥物研發上全面複製中國的生態系並不容易。從基礎研究到供應鏈整合,再到臨床試驗與市場規模,中國已形成高度完整的體系。正如美國新興生物科技國家安全委員會所言,中國在生物製藥創新上超越美國的世界,已不再是未來假設,而是1個正在成形的現實。

2026新年談話提4目標 賴清德盼促成朝野合作引領國家向前走
總統賴清德今(1)日發表「2026新年談話」,回顧2025年台灣經濟成長、社會照顧、國防建設與重大公共工程上的成果,並提出新年度四大施政總目標,包括強化國防安全、推動智慧繁榮、促進均衡發展及深化民主團結。面對中國威脅與朝野對立,賴清德強調捍衛主權、推動國安改革與社會韌性刻不容緩,也呼籲朝野合作,儘速審議總預算與國防預算,讓國家持續穩健向前。賴清德發表「2026新年談話」全文如下:今天是2026年的第一天,祝福大家新年快樂,闔家平安。新的一年,是嶄新的開始。當第一道曙光照亮台灣,無論過去多麼充滿挑戰,我們都懷抱希望,勇往直前。ㄧ、回首過去,感謝人民團結成就過去一年,世界局勢充滿震盪,全球經貿秩序變動,國際衝突加劇,中國擴張的野心持續升高。我們也經歷了幾場天災,和令人痛心的社會事件,考驗著我們的社會韌性、危機意識和全民團結。不過,面對這些考驗,台灣人民不僅沒有被擊倒,反而穩健地締造了許多令人驚嘆的成就。過去一年,我們的經濟成長率創下15年來新高,預估將達到百分之7.37,而台股指數,更是在多變的經貿環境下,屢屢寫下新的紀錄。失業率平均約百分之3,就業情況是25年來最好。我們幫軍公教加薪,也連續10年調升勞工基本工資,將月薪從2016年的2萬零8元,調漲至今年的2萬9千5百元,並帶動企業為員工加薪,讓經濟成長的果實為全民所共享。除了經濟的亮眼表現,我們的「福衛八號」齊柏林衛星,已在太空中運行;桃園機場「第三航廈北廊廳」啟用,也象徵台灣以嶄新門面,擁抱世界。我們的海巡多艘國造的巡防艦也交艦成軍,在海上守護國人安全。而歷經40年等待的國際級建設「淡江大橋」,終於也完成主橋段合龍,今年就要全線通車,不僅打通北部重要交通樞紐,也讓台灣再次以國際級的建設躍上世界舞台。從海洋到太空,從家門到國門,我們用行動證明,只要堅定、團結,沒有台灣人到不了的地方、也沒有無法達成的成就。這些亮眼的成績屬於每一位台灣人民!我也沒有忘記,追求發展之外,我們更要落實照顧,投資未來。國人的健康,始終是我從行醫到從政的使命。因此,我們推動「健康台灣深耕計畫」,也成立了百億規模的「癌症新藥基金」,去年,我們更提早5年達成WHO設定的消除C型肝炎的目標,這也是國際有目共睹的公衛成就。我們更成立「運動部」,投入超過248億預算,讓國家成為選手的後盾,也厚植全民運動,競技運動以及職業運動,讓國人更健康,國家更強,世界擁抱台灣。而政府推動的「青年百億海外圓夢基金計畫」,也已扶持許多優秀的台灣青年到世界各地追夢,讓台灣在世界上發光發熱。過去一年,即使挑戰不斷,我們都逐一克服了。我們沒有因為國際局勢動盪,躊躇不前;更沒有因為時政紛擾,而故步自封。二、展望新年,推動四個總目標新的一年,我們還要繼續大步向前走,達成四個總目標:第一,我們要打造更安全、堅韌的台灣。面對中國持續升高的擴張野心,國際都在關注台灣人有沒有自我防衛的決心。作為總統,我的態度一直都很清楚,就是堅定捍衛國家主權,強化國防及全社會防衛韌性,全面建構有效的嚇阻力量及民主防衛機制。去年,我已經宣布啟動反滲透17項國安策略,加速推動國安十法修法,並透過8年1.25兆國防特別預算投資,全面提升戰力,壯大國防產業,強化國家安全與社會安定,今年,我們要一一來執行。新年的第一天,我也要再次呼籲,面對中國嚴峻的軍事野心,台灣沒有時間等待,更沒有時間內耗。我們可以對許多議題有不同的看法,但沒有強韌的國防,就不會有國家,更不會有我們彼此爭辯的空間。這應該是要不分黨派的全民共識。期盼朝野攜手合作順利讓重要的國防預算趕緊通過。第二,我們要邁向智慧繁榮的台灣。目前,我們的銀行、保險與證券三行業總資產已突破130兆元,10年成長近七成。政府正在推動台灣成為「亞洲資產管理中心」,要讓人才資金深耕台灣,吸引國際資金,精準布局國際市場,為國家創造更多財富。同時,我們也已啟動「AI 新十大建設」、「生技醫療」及「國防工業」等多重引擎,並協助中小微企業在轉型中持續維持競爭力,打造護國群山,確保台灣在下一個世代的競爭優勢。第三,我們要建構更均衡發展的台灣。一、我們追求世代的均衡,不只要照顧長輩,也要照顧年輕人。這是為什麼我們要推動「長照3.0」、以及高中職全面免學費、私立大專校院學生學雜費補助,還有緩解青年壓力的「租金補貼」和「社會住宅」。今年起,我們更將實施「婚育宅」,落實囤房稅2.0,引導空屋釋出,讓年輕人住得起也住得好。未來,我們將根據「青年基本法」,進一步協助年輕人走得更穩。二、我們追求城鄉的均衡,不只要透過產業、醫療、社宅,也要透過交通、鐵道建設,包括高鐵延伸、花東鐵路雙軌電氣化,帶動城鄉均衡發展,讓年輕人找到回鄉發展的機會;也要堅持財政均衡,不該加劇城鄉落差,資源分配更應該合理規劃。所以,針對《財政收支劃分法》所衍生的爭議,朝野應該再透過通盤檢討及討論,推動顧及各層面、各世代、各級政府的全面性財政改革,協助地方穩定財政紀律,也同時讓中央發揮協助地方發展的政策力量。三、我們追求所得分配的均衡,透過加薪、減稅以及社會福利,來降低所得差距,改善分配不均,讓社會公平穩定。明年起單身租屋族年收入64.4萬元以下;雙薪租屋家庭年收入110.8萬元以下;四口之家租屋、有一對6歲以下小孩年收入168.5萬元以下,皆不必繳稅。社會福利政策方面,前年行政院開始推動的「身心障礙照顧服務資源布建計畫」,規劃5年投入經費超過480億元,以及今年將上路的「強化社會安全網計畫2.0」,預計5年投入819.6億元,而上個月,「身心障礙者權益保障法」,行政院院會已經通過修正草案,進一步落實身心障礙者權利公約,這顯示出,社會安全體系越來越健全,可以提供民眾更多支持與服務。而從今天起,每胎可領取社會保險生育給付加計生育補助,合計10萬元;從這個月開始連續13個月,低收入戶每人每月加發1千元,中低收入戶每人每月加發750元。希望今年度的中央政府總預算儘速審議,讓這些福國利民的政策順利推動。未來,將持續擴大社會投資,打造公義、和諧、永續的社會。第四,我們要促成民主團結的台灣。過去一年,許多福國利民的法案,因為政治杯葛,被嚴重延宕;更有許多有違憲之虞的法案,被強行通過。各位國人同胞,民主的真諦,在於即便有不同的意見,大家都願意遵守憲法,以憲政秩序為最大公約數。憲法著重權力分立、相互制衡,憲法也是人民權利的保障書,倘若憲政體制不被遵守,單一權力無限擴張,受苦的都是人民,被毀棄的則是國家。我要感謝憲法法庭秉持專業與道德勇氣,做出符合憲法和人民期待的決定,讓憲法法庭恢復運作,保障人民權益。今天天亮的時候,我相信很多人心情都一樣,期待在這個嶄新的開始,2025的僵局,不會延續到2026。攸關國家的生存發展的建設不會再因杯葛而停滯。身為總統,我會積極行動,促成朝野合作。我也要重申,只要有助於化解對立、凝聚共識,我願意在《憲法增修條文》第4條第3項、以及憲法法庭113年憲判字第9號,所揭示的合憲方式下,赴立法院進行國情報告。我由衷期盼,新的一年,朝野能夠共同努力,讓國家團結一致,一起面對內外部挑戰,開創新局。三、懷抱希望大步向前親愛的國人同胞,2026年是台灣總統直接民選30週年,對於台灣非常關鍵。我們已經奠定非常好的基礎,除了經濟有舉世稱羨的亮眼成績,國際企業也持續加碼投資,世界都看好台灣。同時,國際對台灣的支持從未間斷,不只美國、日本、英國、歐盟等多國,都紛紛展現對台灣及台海和平穩定的支持,近期美國宣布史上最大的對台軍售案,和美國國家戰略報告所提到台灣的重要性,都在在告訴我們,台灣已不只是「不可或缺」,更是國際社會中值得信賴、負責任的良善力量。各位國人同胞,我們沒有時間等待,沒有時間蹉跎,國家必須大步向前走,也絕不能走回頭路。民主給我們彼此爭辯、不同意彼此的權利。但倘若沒有國家,這樣的自由和權利都不存在。我是民選總統,肩負全民付託,我會竭盡一切保護國家,並且捍衛人民得來不易的民主自由生活方式。我們不會因為政治僵局而裹足不前,相反的,我們會懷抱希望,積極行動,即便要迎風頂浪,也要昂首闊步,帶領國家繼續向前。最後,我想感謝這段時間,每個崗位上,守護國人安全的國軍、海巡、警察、消防和醫護弟兄姊妹,以及台灣所有的志工超人們,還有在他們背後扶持他們的家人朋友們,辛苦了。你們的付出,讓國人更安全;你們的無私,印證了台灣人是攜手扶持彼此的命運共同體。無論怎樣的考驗,我們都能一一克服;無論何種挑戰,我們都能攜手共進,寫下台灣奇蹟。也感謝今天主辦元旦升旗典禮的四大醫事團體,以及所有帶來精采表演的夥伴。新的一年,我們一起大步向前走!天佑台灣、福被每一個國家主人!謝謝大家!

告別巨痛針!免疫功坊TE-8214:從「麥芽糖」到「水溶液」的長效藥物革命
長效型胜肽藥物的發展,是現代醫學的一大福音,它顯著改善了病患的生活品質。然而,對於「生長激素分泌異常的相關徵兆」的病患來說,儘管現有治療藥物奧曲肽(Octreotide)已能緩解病徵,但長效型製劑的注射疼痛卻是難以言喻的夢魘。在【生活講堂】節目中,主持人—高葳(Stacey) 專訪了台灣免疫功坊(Immunwork)董事長、被譽為「台灣抗體之父」的張子文博士。張博士在訪談中深入揭示,他們正在研發的創新藥物TE-8214,目標就是要徹底解決這個困擾病患數十年的痛點。舊藥之痛:麥芽糖般的黏稠與結節為了將奧曲肽從原本只有1.5小時的短暫半衰期,延長到能數週注射一次的長效療程,現行市場上的長效緩釋劑(如 Sandostatin LAR)必須採用 Depot(儲藏物)的概念。張博士在節目中生動地形容,這種緩釋劑的劑型,在調製出來後,會變成一種「很黏稠的東西,看起來有點像麥芽糖」。這種極端的黏稠度帶來了災難性的後果:1. 粗針深層注射: 由於藥物黏稠難推,病患必須使用極粗的針頭(例如 18G 或 19G),並深層推入臀部肌肉中。張博士提及,有醫師反應,光是看到這種粗針,有的病患就可能害怕得想跑掉。2. 痛苦結節: 藥物在肌肉內釋放時,會在注射部位形成難以消散的硬塊或結節。這類硬塊可能需要數個月甚至一年才能緩慢消退,嚴重影響病患的日常活動和生活品質。新藥突破:脂肪酸束與白蛋白攜帶的長效機制免疫功坊的TE-8214代表了新一代長效藥物在技術與人文關懷上的雙重突破。張博士指出,TE-8214 運用公司獨有的「脂肪酸束的技術」對奧曲肽進行了全新的修飾,創造出獨步全球的創新藥物。最大的突破,在於劑型的徹底改變:TE-8214不再依賴聚合物形成的網狀結構來緩釋藥物,它本身就是水溶液型態。由於是水溶液,TE-8214可以使用極細的針頭(例如 30G,如同疫苗針般細)進行皮下注射,不再需要痛苦的肌肉深層注射,徹底減輕病患的疼痛。長效機制也更為精妙:TE-8214在被皮下注射後會迅速進入血液系統,並與血液中的白蛋白(Albumin)結合。白蛋白作為體內的攜帶者,將藥物攜帶在血液中,使半衰期延長。這種機制既達到了長效的目的,同時也完全避免了肌肉結節的產生。在專訪的最後,張子文博士強調,他的新藥研發不僅追求有效性,更追求人性化。TE-8214目前正在人體臨床試驗階段,一旦成功上市,將為病患提供一個「無痛、細針、不結節」的治療新選擇,讓病患能夠更積極、更有尊嚴地配合治療。

潤泰寶佳圓祥生技大股東!23日送件申請上櫃 預估明年Q2掛牌
圓祥生技(6945)今(23日)正式送件櫃買中心申請股票初次上櫃,預計最快2026年第二季掛牌;根據公開的前十大股東資料,包括浩鼎、尹衍樑潤泰集團與寶佳林家宏等。圓祥生技設立於102年5月27日,為一臨床階段雙特異性抗體新藥研發公司,針對目前未滿足醫療需求,透過自行設計技術平台開發出一系列抗體與蛋白質先導藥物,著重於與疾病相關特定靶點,以提供安全、有效和具有成本效益的藥物。圓祥生技目前實收資本額8.5億元,董事長為陳志全,總經理為何正宏,截至114年11月30日,全體董事持股比例31.40%。總經理何正宏博士指出,旗下兩項核心授權資產IBI302與AP505隨著授權談判推進與臨床數據發表。針對濕式黃斑部病變(wet AMD)及糖尿病引起的黃斑部水腫開發的IBI302,目前濕式黃斑部病變三期臨床試驗已進入取得主要療效指標(視力矯正)的最後階段,授權夥伴信達生物後續將進行主要療效與安全性數據分析。據推估已有多家廠商和信達針對IBI302海外授權積極展開洽談。關於眼藥的授權市場,2024年國際大藥廠默沙東以總額約30億美金收購專注眼科經營的公司Eyebio(產品為臨床二期的抗體藥物),IBI302的潛在交易規模,有機會參照同類藥物市場價值及授權案例,此外,依據與合作夥伴的協議,圓祥生技將可獲得再授權金之分潤,若成功授權,將顯著挹注公司營運資金。圓祥另一項主力產品AP505(PD-L1 x VEGF雙抗),由中國授權夥伴天士力醫藥負責開發,在一期臨床展現安全性與具臨床價值的初步療效, 並已於2025年初同步展開兩個二期臨床試驗(中國),其中一個特別針對大腸直腸癌,這對圓祥研發團隊而言,是一個非常振奮人心的消息。圓祥目前正與天士力醫藥協議由圓祥主導將AP505中國以外市場授權給第三方,已有超過5家,包含全球前15大國際藥廠前來探詢,並已獲得1家美國投資銀行表達高度意願擔任本專案財務顧問,以加速圓祥與潛在授權夥伴的商務進程。此外,近兩年國際上與圓祥AP505相同雙抗靶點的授權案,包含BMS和BioNTech總交易金額約111億美元、輝瑞與三生製藥授權合計12.5億美金、默沙東與禮新醫藥授權合計5.9億美元,都顯示國際大藥廠對於雙抗藥物市場未來發展的積極度和信心。除了上述兩大核心資產外,圓祥生技基於T-cube雙抗技術平台所開發的研發管線,也同樣穩健推進,臨床一期研究目前進行順利。何正宏表示,AP203 (PD-L1 x CD137):鎖定PD-L1治療無效或惡化之晚期非小細胞肺癌(NSCLC)患者,預計2026年第一季推進至600 mg有效劑量組,並於2026年下半年完成一期(台灣)臨床試驗。AP402(p95HER2 x CD137):為全球首創(First-in-class)之p95HER2藥物,鎖定HER2標靶藥物治療失敗或復發實體腫瘤,預計於2026年第四季完成一期(澳洲)臨床試驗。AP601(CD73 x CD137):鎖定免疫冷腫瘤之全球首創(First-in-class)CD73 x CD137雙抗藥物,預計於2026年初首位受試者收案。
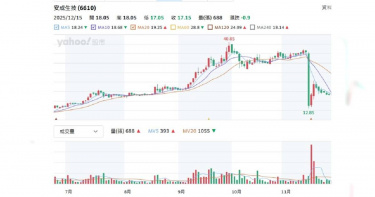
新藥股大漲跌2/研發路漫漫「臨床失敗」即斷頭 授權訂單分潤看實績
專注新藥研發製造個股中,近期股價大跌包括安成生技(6610)、合一生技(4743)等均以創新藥為核心,卻因臨床試驗失敗、終止部分藥物開發、營收挹注未明顯奏效等利空消息,影響股價受挫,投資人荷包大失血。CTWANT調查,安成生技2025年11月16日夜爆NORA520(用於治療產後憂鬱症/PPD)美國二期臨床未達標,給藥組與安慰劑差異無統計顯著性,股價隔日開盤36元跳水至12.85元,跌64.31%,觸發熔斷暫停交易。這是台股生技史上罕見單日之例;至周五的收盤股價逐漸回升到16.40元。安成表示,「本試驗為一項隨機、雙盲、安慰劑對照研究,納入93名成人女性重度產後憂鬱症患者,以1:1:1比例分組,三天住院口服治療。主要療效指標未達標,但精神健康領域存在高度未滿足需求;重申團隊將以謹慎科學態度,完成進一步分析後,以確保NORA520未來開發策略,合乎市場需求與法規指引除了NORA520 之外,研發管線中另一項藥物AC-203正進行全球第二/三期的臨床試驗,已在全球18個國家,35個試驗中心全面進行收案,預期於2026年第一季進行期中分析。安成生技2025年股東會通過合併杜康藥業,圖左二杜康董事長陳志明,中為安成生技董事長吳怡君,右二為安成生技總經理蔡承恩。(圖/報系資料照) 合一生技則是8月28日公告終止肝癌藥OB318開發,股價隔天雖從75.6元下跌到收盤價70元,9月初漲到78.5元,之後逐漸下滑到11月下旬的57.3元;接下來則是上漲到72.7元;12月7日中國國家醫保局公布首版《商業健康保險創新藥品目錄》之後,股價再跌一波,到本周五收盤價58.2元。合一將在12月24日舉行第三季線上法說會,最新公告Bonvadis外用乳膏取得印度醫藥品監管機構(CDSCO)核准完全傷口適應症之醫材上市許可;「速必一」新藥(研發代號ON101)通過促進傷口癒合的外用製劑配方加拿大發明專利。先看合一官網刊登去(2024)年7月時的新聞內容,開盤跳空漲停來到185.5元,主要是受到糖尿病足潰瘍新藥「速必一」授權給中國華潤集團旗下華潤雙鶴藥業締結20年長約消息激勵,華潤雙鶴取得速必一在大陸市場的獨家銷售權,簽約金最高達3350萬美元(約新台幣10.98億元),以及後續合理產銷利潤、權利金等。只是,合一今(2025)年11月營收820.7萬元,較去年同期的949.1萬元,減少13.53%;累計營收9850.3萬元,較去年同期的1.06億元,減少7.58%;前三季虧損逾10億元,每股盈餘損失2.11元,股價一路溜滑梯。每一家公司對新藥開發都有前景與希望,但也都強調,「新藥開發風險高、時程長、不保證成功」,請投資人審慎評估。
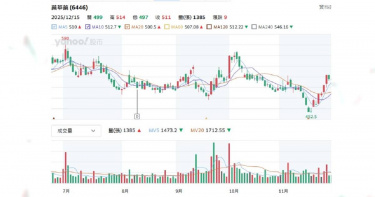
新藥股大漲跌1/這二檔營收利多股價亮眼 「它」納入中國目錄成亮點
台股力拼站回28K,AI概念股仍是主旋律,大數據分析等科技導入生技醫療產業也加速新藥研發進程,臨床試驗數據一翻兩瞪眼好壞在眼前,CTWANT調查2025年股價亮眼上漲與慘跌共四檔新藥股,2026年展望是個個有希望,最關鍵的還是營收財報給證據。 先來看看最新一例,2025年12月7日中國國家醫保局公布首版《商業健康保險創新藥品目錄》,納入18家企業19款高值創新藥,聚焦CAR-T、雙抗、罕見病及阿茲海默症等超出基本醫保範圍的產品,研發PTS肺癌新藥的共信-KY(6617)子公司天津紅日健達康醫藥科技公告「治療中央型氣道阻塞產品-PTS302」,成為台股唯一上榜個股,消息曝光,股價從78.8元上漲到86.6元,旋即又短暫下跌86.4元,再逐步漲到15日收盤價90.5元,到這周連四跌、周五收盤價85元。 CTWANT調查,共信12月3日公布11月合併營收259.1萬元,年減12.5%,累計雖年增11.42%,但投資人擔憂目錄效應需時間轉化實際訂單。 至2025年12月15日止,觀察仁新醫藥(6696)、藥華藥(6446)個股股價變化,其均以創新藥為核心,近期受臨床進展、營運利多驅動,股價有所表現。仁新醫藥近一月從270元上漲到最高442元,近三月則從162元漲到周五收盤407元;藥華藥近一月從453元漲到最高519元,近三月則最高漲到559元。仁新醫藥專注罕見疾病新藥,子公司Belite Bio(美國納斯達克BLTE)Tinlarebant三期臨床於2025年12月1日公布,針對青少年斯特格病變臨床三期試驗(DRAGON)解盲之關鍵性數據亮眼,共收案104位青少年受試者,並成功達成主要療效指標。Belite董事長暨執行長林雨新醫學博士表示,「DRAGON最終試驗結果讓斯特格病變疾病治療迎來了歷史性突破,Tinlarebant將成為首個治療這種具威脅性疾病的潛在新藥,期盼藉此帶給無藥可醫的患者及其家屬治療新希望。」BLTE股價從今年初低點62.09美元,漲到近期的最高點156美元,「三期解盲成最大催化劑。」證券分析師表示。Belite規劃於2026年上半年與各國監管機構討論Tinlarebant的潛在後續計畫與新藥查驗登記申請(NDA)送件事宜,並向美國FDA遞交新藥查驗登記申請(NDA)。Belite宣布Tinlarebant抑制視網膜萎縮進展達預期,股價飆至新高,仁新持股 43.94%間接受惠,募資126億元不折價增資當日完成。仁新2026年關鍵為Tinlarebant FDA核准,預計上半年送NDA。藥華藥向美國FDA申請Ropeg新適應症「原發性血小板過多症(ET)」,目標2026上半年取證。圖左起為執行長林國鐘、董事長詹青柳、總經理黃正谷。(圖/CTWANT資料照)藥華藥旗下真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(Ropeg,P1101)用於新適應症罕病血癌藥銷售勁揚,股價高檔震盪,10月底完成向美國FDA申請Ropeg新適應症「原發性血小板過多症(ET)」送件,若順利獲准,最快有望於2026年上半年取得美國ET藥證,成為公司啟動第二成長曲線的重要動能。藥華藥11月營收15.5億元,月增10.63%,年增53.02%,已連續3個月刷新單月歷史新高;累計前11個月達137.11億元,較去年同期的86.02億元,成長59.38%;前三季獲利達35.69億元,年增翻倍,每股盈餘9.66元,賺近一個股本。根據CTWANT調查,藥華藥也正同時研發新款癌症藥物。此外,Ropeg筆型注射劑的補充性生物製劑查驗登記申請(sBLA)審查亦同步進行中。FDA已通知審查目標完成日(PDUFA date)為2026年2月14日。

9家藥廠與川普簽署協議!降低藥品價格換「關稅寬限期3年」
多家美國與歐洲最大的製藥公司於美東時間19日與美國總統川普(Donald Trump)達成協議,自願以更低價格販售藥品,配合其政府推動將美國藥價與海外較低價格掛鉤的政策方向。參與這項協議的藥廠包括默克(Merck)、必治妥施貴寶(Bristol Myers Squibb)、安進(Amgen)、吉利德科學(Gilead)、葛蘭素史克(GSK)、賽諾菲(Sanofi)、羅氏(Roche)旗下的基因泰克(Genentech)、百靈佳殷格翰(Boehringer Ingelheim)以及諾華(Novartis)。作為交換條件,這9家公司獲得為期3年的寬限期,其產品在此期間不會受到川普計畫中的「藥品專屬關稅」影響,前提是藥廠必須進一步投資於美國本土製造。19日公布的承諾中,最引人注目的是必治妥施貴寶同意,將其暢銷抗凝血藥物、也是美國處方量最高的產品之一艾必克凝(Eliquis)免費提供給「聯邦醫療補助計畫」(Medicaid)。川普曾在7月致函包括上述公司在內的17家大型製藥商,要求它們配合其「最惠國待遇」(most favored nation)政策降低藥價。川普在5月簽署行政命令,重新啟動該政策,主張提高美國以外市場的藥價,並稱此舉是為了「終結全球搭便車行為」(end global freeloading)。川普在19日的活動上表示,截至目前,17家最大製藥公司中已有14家同意大幅降低藥價,讓美國人民與病患受惠。他強調,這是「美國醫療史上,病患負擔能力方面最重大的勝利」,而且「每1位美國人都將因此受益。」在尚未簽署藥價協議的主要藥廠中,包括嬌生(Johnson & Johnson)、艾伯維(AbbVie)與再生元(Regeneron)。不過川普指出,嬌生「下週就會到場」。至於這些藥價協議實際將如何運作,目前尚未立即公布完整條款,因此其影響範圍仍不明朗。這9家藥廠同意採取多項措施來降低美國藥價,包括以「最惠國待遇」的最低價格,向聯邦醫療補助計畫病患販售既有療法,並對新藥價格作出保證。川普表示,這些藥廠也同意,將旗下最受歡迎的藥品上架至即將推出的消費者直售網站「川普藥品平台」(TrumpRx),該平台預計於1月上線。部分公司同時推出新的,或擴大既有的消費者直售方案。舉例來說,吉利德表示,將推出1項計畫,使病患能以折扣價格取得其C型肝炎治療與治癒藥物宜譜莎(Epclusa)。賽諾菲則表示,將在TrumpRx及其他消費者直售平台上,針對治療感染、心血管疾病與糖尿病的部分藥物,提供接近7折的折扣。默克指出,將透過直達病患的計畫,向自費患者提供3款糖尿病藥物約7折的價格優惠,包括佳糖維(Januvia)、捷糖穩(Janumet)與捷糖穩XR(Janumet XR)。該公司也表示,若其實驗性每日口服降膽固醇藥物未來在美國獲准上市,該計畫也將適用於該藥品。默克執行長戴維斯(Robert Davis)在記者會上表示,他理解川普推動藥品可負擔性與美國民眾用藥可近性的目標,同時也包括提高美國以外市場的藥價,並強調默克「百分之百支持」相關行動。另一方面,安進將擴大其既有的直達病患計畫,納入預防性偏頭痛藥物安莫疼(Aimovig)以及自體免疫疾病治療藥物「Amjevita」,分別提供6折與2折的每月折扣價格。今年稍早,川普已宣布與禮來(Eli Lilly)、諾和諾德(Novo Nordisk)、輝瑞(Pfizer)、阿斯特捷利康(AstraZeneca)以及默克雪蘭諾(EMD Serono)達成協議,這些公司同意以折扣價直接向病患販售部分藥品,換取免除未來藥品關稅以及其他好處,例如新藥審查加速。根據蘭德公司(Rand Corp.)2024年的1項研究,美國處方藥價格平均幾乎是海外市場的3倍,其中品牌藥物價格甚至超過4倍。對此,代表多家大型製藥公司的產業協會美國藥品研究與製造商協會(PhRMA)表示,川普的「最惠國待遇」定價並非降低美國藥價的最佳方式,並將美國與海外藥價差距歸咎於藥物福利管理者(pharmacy benefit managers,PBMs)。對多數藥廠而言,美國都是最重要的單一市場,無論其總部設於何處。即使以歐洲為基地,歐洲大型製藥公司也高度依賴美國市場,歐洲前10大藥廠中,有一半以上的公司,其大部分營收來自美國。

藥華藥再捷報!Ropeg完成申請美國ET藥證 拚2026取證
藥華藥(6446)再報佳績,11月營收再創新高之外,旗下新藥Ropeginterferon alfa-2b-njft(Ropeg,即P1101)於美國申請原發性血小板過多症(ET)新適應症藥證進展順利,已完成與美國食品藥物管理局(FDA)的送件說明會議(AOM),預計2026年取證。藥華藥於12月8日以視訊方式與FDA審查官員召開ET藥證申請之AOM,AOM(Application Orientation Meeting)為公司提交藥證申請後,與FDA審查官員團隊舉行的首次正式會議。會中,公司向FDA審查官員深入說明申請文件架構、臨床效益摘要、藥物機轉及安全性等重點。透過AOM,公司得以引導審查官員在龐大的臨床資料中聚焦關鍵數據,並協助FDA在啟動實質審查前即可掌握送件資料的核心脈絡。藥華藥11月營收15.5億元,月增10.63%,年增53.02%,已連續三個月刷新單月歷史新高。藥華藥2025年10月底向美國FDA申請Ropeg的ET藥證,並已獲FDA確認,若於收件日起60日內FDA未通知其他意見,本案將依法於2025年12月29日正式進入實質性審查程序。 Ropeg為藥華藥自行發明生產的新一代創新長效型干擾素,至今已獲全球約50個國家核准用於真性紅血球增多症(PV)患者並上市銷售,包括歐盟、美國及日本等主要新藥市場,全球用藥人數及銷售穩健成長。持續拓展Ropeg新適應症,ET與PV同屬骨髓增生性腫瘤(MPN),病人數亦相近。
ADCC缺乏症治療納健保惹議 王婉諭喊生命無價:罕病不該效益論
時代力量黨主席王婉諭今(2)日表示,近期有醫師將ADCC缺乏症(芳香族L-胺基酸類脫羧基酶缺乏症)每針新台幣近1億元基因治療花費由健保來扛的政策,講成是「剜肉補瘡」排擠別的資源,這種說法是太殘酷,畢竟罕病是基因纏上門,根本無從預防,健保本來就需要承擔這類風險,且生命無價,對罕病家庭來講,多活一天都是最寶貴的饋贈。罕見疾病AADC缺乏症是基因突變的體染色體隱性遺傳疾病,這會影響多巴胺和血清素的製造,進一步影響運動控制、情緒調節、內分泌及心血管功能等多個生理系統。據了解,若父母雙方皆帶有異常基因,則子女有四分之一機率患病,而台灣ADCC缺乏症發生率比全球高得多,台灣大概每3萬名新生兒中即有1人罹患此病。時代力量黨主席王婉諭(圖)長期關心罕病家庭。(圖/周志龍攝)此外,據臨床文獻記載,由於ADCC缺乏症症狀多樣又容易被誤診成腦性麻痺等其他問題,因此診斷需仰賴醫師經驗與警覺性,如有必要會透過腰椎穿刺抽取腦脊髓液,檢驗其中神經傳導物質及其代謝產物的含量比例以確診,目前這項篩檢也已納入新生兒篩檢項目範疇。 儘管過去ADCC缺乏症幾乎無藥可醫,讓病童多數難以活超過5歲,但近年由臺大醫院團隊研發出一種創新的基因替代療法,透過立體定位神經外科手術將功能性基因包裹在腺病毒載體中,接著直接注射到大腦特定的「豆狀核」區域,讓患者體內能開始重新合成多巴胺,並逐步達成正常運動發展。這項罕病藥物技術要價近億元,並已於2025年12月起納入台灣健保,限縮適用範圍在18個月以上至6歲以下的患者。ADCC缺乏症治療納入健保是否有當,各界爭論不休。圖為藥房示意,無指涉當事人。(示意圖/黃耀徵攝)然而,網紅胸腔科醫師蘇一峰則不以為然地指出,健保12月起決定花費龐大預算,讓患者壽命從用藥前平均7歲壽命延長到20多歲餘命,而且新藥並非完全能治癒疾病,患者注射後仍需要一輩子醫療照顧,健保有限資源還可能排擠到更多病患的健保資源,此話一出引起「救命」與「浪費」兩派舌戰。王婉諭對此表示,AADC缺乏症這種基因問題除非父母特地篩檢,不然根本無法預防,這樣的罕病正是健保存在的原因,多少罕病家屬明知有解藥,卻因天價治療費無力負擔,只能眼睜睜看著孩子在眼前病故,那種無力感將壓垮一個家庭,如今要用效益估計,何其殘忍。王婉諭強調,健保問題根源在於不敢正視財務結構失衡,加上「二代健保補充保費」規則既不公平也不永續,如今要拿特定藥品補助獵巫,根本無濟於事,若不全面改革開源,未來醫療體系的崩壞只是早晚的事。

全球唯一!英美達成「零關稅協議」 英國藥品出口美國免關稅
英國政府1日宣布,英美雙方已達成一項重大協議,未來至少三年內,英國輸往美國的所有藥品可享有零關稅待遇,涵蓋藥品本身、藥品成分以及醫療科技產品;作為交換,英國將提高對新藥的投入。而此為美國目前提供給任何國家中最低的稅率。根據《美聯社》報導,協議內容指出,美國同意全面豁免英國來源的相關醫藥產品進口稅。美國政府表示,作為回報,英國藥廠承諾將在美國加大投資並創造更多就業機會。英國政府指出,此次取得在未來至少三年內,對所有英國出口藥品實施0%關稅待遇,是美國目前提供給任何國家中最低的稅率。英國同時承諾,其國家醫療服務體系(NHS)將在新穎且有效的治療項目上增加約25%的投入,這是二十多年來首次的重大增幅。政府官員表示,增加預算後,英國衛生主管機關將能批准更多能帶來明顯健康改善、但過去可能因成本效益因素而遭拒的藥物,包括突破性的癌症療法與罕見疾病治療方式。而英國科技與科學部長Liz Kendall指出,「這項重要協議能讓英國患者更快取得最先進的藥物,也確保我們世界領先的英國企業持續研發能改變生命的治療方式。」英國製藥工業協會(ABPI)則表示,這項協議是「讓患者能取得創新藥物、提升NHS整體健康成果的重要一步」。協會執行長Richard Torbett認為此舉也將使英國更具吸引力,有利於爭取與留住全球生命科學投資及先進醫藥研究。美國衛生部長甘迺迪(Robert F. Kennedy Jr.)也同步表示,此協議「強化了全球創新醫藥的環境,也為美英藥品貿易帶來期待已久的平衡」。近月來,包括阿斯特捷利康(AstraZeneca)在內的多家大型製藥公司,相繼取消或暫停在英國的投資。美國駐英大使史蒂芬斯(Warren Stephens)甚至警告,若英國不儘速改革,未來美企可能減少投資。今年稍早,美國總統川普(Donald Trump)與英國首相施凱爾(Keir Starmer)已達成框架協定,將大幅調降美國對英國汽車、鋼鐵及鋁產品的進口關稅,以換取美國牛肉、乙醇等產品更大的進入英國市場的空間。

12月多項新制上路 TPASS升級回饋30%、iPASS MONEY要另下載APP
2024年12月起,多項政策與制度陸續上路,涵蓋交通、健保、數位支付與長者福利等領域。其中,交通部升級推出TPASS 2.0+方案,國道客運最高享30%回饋;健保新增單劑要價達1億元的罕病用藥;iPASS MONEY平台服務轉移至專屬App;臺北市敬老卡則擴大應用範圍,年底前可用於泡溫泉。【TPASS 2.0+優惠擴大】交通部自今年1月推動TPASS 2.0公共運輸常客優惠方案,每月搭乘公共運具滿11次可享最多30%回饋。12月1日起升級為TPASS 2.0+,凡搭乘國內91條中長途國道客運路線,每月搭2次可獲15%回饋、4次以上可享30%回饋,其他運具則維持原有條件。【臺鐵調整車型並加開班次】臺鐵公司宣布,自114年12月23日起調整部分列車車型與班次。彰化-花蓮間的278次與285次列車將改為EMU3000型自強號,樹林-花蓮間224次與235次則調整為普悠瑪。另新增臺中-潮州間EMU3000型自強號191與196次列車,以及彰化-竹南間下午區間車2班,提供更彈性運能。【健保納入高價罕病用藥】健保署公告,自12月起新增3項健保藥品給付,涵蓋轉移性胰臟癌、停經後轉移性乳癌及芳香族L-胺基酸脫羧酶缺乏症(AADC)藥物。其中AADC為罕病新藥,單劑藥價高達1億元,預估首年約有13人使用,整體藥費高達13億元。【iPASS MONEY服務調整】一卡通公司公告,自2025年12月3日起,LINE Pay錢包中的iPASS MONEY僅保留查詢餘額、提領、好友轉帳與帳戶紀錄查詢等功能。若欲使用儲值、轉帳、消費等完整功能,民眾需另行下載iPASS MONEY專屬App操作。【北市敬老卡點數可泡湯】臺北市政府擴大敬老卡使用範圍,年底前卡友可使用點數於特約業者折抵泡湯費用,目前已有約20家業者參與。至於是否可擴及至KTV使用,因涉及產業管理層面,社會局仍在研議可行性。

藥華藥大漲22元、4.85%!新藥創美FDA近30年 「首件」申請ET藥證
台股20日強彈收在27,426.36點,大漲846.24點,漲幅達3.18%;台積電漲60元收在1455元。新藥股中的藥華藥(6446)在最新公布Ropeg應用於治療ET的全球第三期臨床試驗「SURPASS ET」成果,邀請到競爭對手Incyte前總座Barry Flannelly擔任美國子公司獨立董事,喊出目標營收10倍成長,激勵股價收在475.5元,漲22元,漲幅達4.85%。藥華藥旗下真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(簡稱Ropeg, 即P1101)用於新適應症「原發性血小板過多症」(ET)的全球藥證申請,繼陸續完成中國、臺灣、日本ET藥證申請,近期更於美國時間10月30日完成美國ET藥證申請送件,為近30年來業界首度向FDA申請ET藥證,創下ET領域新藥里程碑,目標2026年取證。FDA已發函通知,若自收件日起60日內FDA未通知其他意見,本案將依法於2025年12月29日正式進入實質性審查程序。藥華藥執行長林國鐘表示,這是近 30 年來業界首度向美國FDA申請ET藥證,非常珍貴。Ropeg用於治療ET的第三期臨床試驗結果已充分顯示Ropeg對ET病患極具顯著臨床效益。目前ET的主要用藥是愛治(HU)和ANA,但其療效與耐受性仍十分有限。Ropeg不僅具有優於現行治療潛力,更有望成為第一個獲FDA核准可同時治療PV和ET的藥物,滿足MPN領域的醫療迫切需求,領航MPN市場。此外,藥華藥19日公布Ropeg應用於治療ET的全球第三期臨床試驗「SURPASS ET」成果,董事長詹青柳、執行長林國鐘表示,SURPASS ET是一項開放性、多中心、隨機分配、有效藥物對照之臨床三期試驗,以比較Ropeg與安閣靈(Anagrelide, ANA)做為二線治療對於ET之療效、安全性與耐受性。本試驗療程共12個月,並以受試者第9個月及第12個月均有療效反應為主要療效指標。另一方面,SURPASS ET更採用了Ropeg的快速遞增劑量方案(250mcg-350mcg-500mcg),以更高的起始劑量施打Ropeg,並更快施打到目標劑量。研究結果顯示,Ropeg組在持久臨床反應率方面明顯優於使用ANA的對照組(42.9% vs. 6.0%;p=0.0001),達到統計上顯著意義,展現了明確的臨床優勢。該研究成果於2025年美國臨床腫瘤學會(ASCO)年會中進行口頭報告,榮獲「Best of ASCO」年度精選論文肯定,並入選歐洲血液學協會(EHA)年會六大頂尖摘要之一,於最高榮譽的主會場(Plenary Session)發表,令醫師們印象極為深刻。SURPASS ET成果更於今年11月登上國際三大權威期刊之一《The Lancet》的血液學子刊《The Lancet Haematology》,不僅代表Ropeg在血液腫瘤治療領域的臨床價值獲得學術領域的關鍵肯定,也將成為未來臨床應用與治療指引的重要依據,並進一步提升Ropeg在血液腫瘤領域的國際能見度與學術影響力,更有助於後續藥證申請的審查和全球市場的拓展。

新藥臨床二期未達標 安成生技股價跌逾60%、暫停舉辦法說會
安成生技(6610)旗下開發中新藥 NORA520 用於治療產後憂鬱症(PPD)之美國第二期臨床試驗,取得主要療效指標之統計數據,結果給藥組與安慰劑組之間的差異並未達到統計學顯著意義,17日股價跌幅61.76%,預計明天召開的法說會也宣布暫停舉辦。安成生技今天收在13.95元,跌22.53元,跌幅61.76%,成交量1,445張,上周五收在36.48元,成交量為832張。安成生技表示,該試驗為一項隨機、雙盲、安慰劑對照之研究,共納入九十三名成人女性重度產後憂鬱症患者,並以一比一比一的比例分派至安慰劑組及兩組不同給藥頻率的 NORA520 治療組,受試者自首次服藥起進行為期三天的住院口服治療。試驗設計採取封閉式檢定程序(closed testing procedure),以控制多重檢定 (multiplicity testing)所可能產生的統計偏差,主要療效指標(primary endpoint)則為受試者於第四天的漢氏憂鬱量表(HAM-D17)分數相較基線的差異,以及包括用藥後八天和三十天的療效等次要療效指標(secondary endpoints)。根據此次主要療效分析,兩組 NORA520 給藥組的合併結果與安慰劑組相比未達統計上顯著差異,p 值為 0.72。然而在整體安全性方面,試驗過程中未發生任何嚴重不良事件。少數患者雖有嗜睡情況,但給藥組與安慰劑組發生率相當,整體耐受性表現良好,顯示 NORA520 在短期給藥下具良好安全性。安成生技表示,從初步數據來看,在兩個給藥組有近一半的的病患達到療效反應率,但安慰劑組呈現大致相當的反應率。研究團隊正全方面評估造成此結果與預期不同的可能原因,並就各項療效指標、分層分析、藥物血中濃度等方面進行細部評估。在完成進一步分析後,安成將重新檢討並修正 NORA520 後續的臨床開發策略。安成強調,雖然本次試驗主要療效指標未達統計顯著性,但精神健康領域存在高度未被滿足的需求,團隊將持續以謹慎且科學的態度審慎進行後續工作,以確保NORA520未來開發策略合乎市場需求與法規指引。安成除了NORA520 之外,研發管線中另一項藥物AC-203正進行全球第二/三期的臨床試驗,已在全球18個國家,35個試驗中心全面進行收案,預期於明(115)年第一季進行期中分析。

諦醫生技以新一代ADC技術,敲開生技奧斯卡大門
近日,台灣生技界傳來一則振奮人心的消息:諦醫生技入圍了素有「生技界奧斯卡」之稱的世界 ADC 獎(12th WORLD ADC Awards)。這項提名不僅是諦醫生技的榮耀,更是對台灣新藥發展實力的一次重要肯定。諦醫生技創辦人,同時也是深耕免疫學界數十年的張子文博士,在「生活講堂」節目中與主持人高葳Stacy分享了這份喜悅,並深入淺出地揭開了ADC藥物的神秘面紗。什麼是 ADC?生技界的「聰明炸彈」「ADC,就是 Antibody-Drug Conjugate,抗體-藥物複合體。」張博士他用了一個生動的比喻:ADC 就像一枚「聰明炸彈」。A (Antibody / 抗體): 是一群具有精準導航系統的「轟炸機」。它們被設計成只會辨識並鎖定(Target)特定的癌細胞。D (Drug / 藥物): 則是極其強效、劇毒的小分子「炸彈」。這些炸彈本身沒有專一性,如果隨意投放,會傷及無辜(即健康的細胞),這就是傳統化療副作用巨大的原因。C (Conjugate / 複合體): 就是將「炸彈」精確地掛載到「轟炸機」上的技術。ADC 的核心理念,就是利用抗體的精準導航,將高效劇毒的藥物,專一性地帶到癌細胞所在地,從而精準擊殺癌細胞,同時最大限度地降低對正常細胞的傷害。劃時代的演進:「高掛載」且可攜帶「雙彈頭」ADC 的概念雖已存在逾百年,但早期技術並不成熟。張博士形容,早期的 ADC 轟炸機,有的掛了兩三顆炸彈,有的甚至沒掛好就起飛了,效果自然大打折扣。而諦醫生技的突破,正是在於開發出新一代的平台技術。張博士自豪地介紹了他們的兩大技術亮點:1.High-DAR (高藥物抗體比):傳統 ADC 轟炸機只能掛載 2 或 4 顆炸彈,而諦醫的技術可以穩定地掛載到 8 顆,甚至 12 顆。火力(藥效)顯著增強。2.Dual-Payload (雙彈頭):更關鍵的是,諦醫的平台能讓轟炸機同時攜帶兩種不同功能的炸彈。張博士比喻:「就像你到了目的地,有的炸彈要去炸引擎,有的要去炸油箱。」這種多重打擊,讓癌細胞更難逃脫。ADC領域之所以被視為當前新藥發展最熱絡的領域,正是因為大家都在競相開發「下一代」的技術。目前,ADC藥物在癌症等領域,都展現了比傳統化療高出許多的「反應率」(Response Rate)。更令人振奮的是,諦醫生技目前在動物模型實驗中發現,他們的 ADC 藥物對於那些已經產生「抗藥性」(Resistance)的癌細胞,依然展現出良好的效果。這意味著,對於那些使用現有藥物已無效的病患,諦醫的研發帶來了新的希望。一位科學家的「退而不休」對研發熱情永不熄滅談及這項入圍,張博士雖謙虛地表示這只是「很有鼓勵性」,真正的成就仍是將藥物成功推上臨床。但主持人也好奇,為何選擇在屆退之齡(2014年)再次投身艱苦的創業之路?張博士眼中閃爍著光芒。他提到,2011至2015年間,有三個沉寂了二三十年的免疫學相關領域——免疫查核點抑制劑、CAR-T,以及 ADC——突然間「開花結果」。「做為一個研究了幾十年(自 1975 年起)的免疫學家,突然在那個時間點,有這些東西出來了... 讓我非常振奮。」這股興奮激發了他的新發明,包括用以開發ADC的「藥物束平台」(Drug Bundles)。而他人生中最有滿足感的經歷,莫過於前一次創業(TANOX),耗時 16、17 年開發出治療哮喘和過敏的藥物 Xolair。那種「藥物最終可以治療很嚴重病人」的滿足感,驅使他再次投身新藥開發。諦醫的願景:打造「世界級的藥物」新藥研發是一條動輒10年、15年的漫漫長路。張博士強調,諦醫在選擇研發項目時,標準極高:必須有顯著療效差異、藥理機制必須扎實、必須有專利保護,且必須能生產。他們更要「勇敢」地做出「Go/No-Go」的決定,絕不拖延失敗的項目。張博士坦言,台灣有數百家生技公司,但真正被美國FDA核准為「新化學實體」(NCE)的藥物,至今只有兩件。而他的目標,就是帶領諦醫生技「發展出至少一個,或兩三個世界級的藥物」。「如果你的藥物是世界級的,這個公司就可以說是一個世界級的生技公司。」目前,諦醫生技正穩健地朝著上市(櫃)的目標前行。如同張博士在訪問中提到的,新藥研發不僅是為了讓病患「活下去」,更是為了讓他們「好好的活下去」,減少治療過程的痛苦與副作用。這次的世界ADC獎入圍,是國際對諦醫生技創新技術的認可,也是一個重要的里程碑。我們期待這家由擁有50年研發經驗的資深科學家所領軍的台灣公司,能持續在癌症治療的尖端領域,為全世界病患帶來更美好的未來。