雙盲
」 新冠肺炎 臨床試驗 疫苗 安慰劑 周軒瑋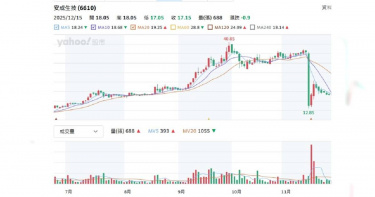
新藥股大漲跌2/研發路漫漫「臨床失敗」即斷頭 授權訂單分潤看實績
專注新藥研發製造個股中,近期股價大跌包括安成生技(6610)、合一生技(4743)等均以創新藥為核心,卻因臨床試驗失敗、終止部分藥物開發、營收挹注未明顯奏效等利空消息,影響股價受挫,投資人荷包大失血。CTWANT調查,安成生技2025年11月16日夜爆NORA520(用於治療產後憂鬱症/PPD)美國二期臨床未達標,給藥組與安慰劑差異無統計顯著性,股價隔日開盤36元跳水至12.85元,跌64.31%,觸發熔斷暫停交易。這是台股生技史上罕見單日之例;至周五的收盤股價逐漸回升到16.40元。安成表示,「本試驗為一項隨機、雙盲、安慰劑對照研究,納入93名成人女性重度產後憂鬱症患者,以1:1:1比例分組,三天住院口服治療。主要療效指標未達標,但精神健康領域存在高度未滿足需求;重申團隊將以謹慎科學態度,完成進一步分析後,以確保NORA520未來開發策略,合乎市場需求與法規指引除了NORA520 之外,研發管線中另一項藥物AC-203正進行全球第二/三期的臨床試驗,已在全球18個國家,35個試驗中心全面進行收案,預期於2026年第一季進行期中分析。安成生技2025年股東會通過合併杜康藥業,圖左二杜康董事長陳志明,中為安成生技董事長吳怡君,右二為安成生技總經理蔡承恩。(圖/報系資料照) 合一生技則是8月28日公告終止肝癌藥OB318開發,股價隔天雖從75.6元下跌到收盤價70元,9月初漲到78.5元,之後逐漸下滑到11月下旬的57.3元;接下來則是上漲到72.7元;12月7日中國國家醫保局公布首版《商業健康保險創新藥品目錄》之後,股價再跌一波,到本周五收盤價58.2元。合一將在12月24日舉行第三季線上法說會,最新公告Bonvadis外用乳膏取得印度醫藥品監管機構(CDSCO)核准完全傷口適應症之醫材上市許可;「速必一」新藥(研發代號ON101)通過促進傷口癒合的外用製劑配方加拿大發明專利。先看合一官網刊登去(2024)年7月時的新聞內容,開盤跳空漲停來到185.5元,主要是受到糖尿病足潰瘍新藥「速必一」授權給中國華潤集團旗下華潤雙鶴藥業締結20年長約消息激勵,華潤雙鶴取得速必一在大陸市場的獨家銷售權,簽約金最高達3350萬美元(約新台幣10.98億元),以及後續合理產銷利潤、權利金等。只是,合一今(2025)年11月營收820.7萬元,較去年同期的949.1萬元,減少13.53%;累計營收9850.3萬元,較去年同期的1.06億元,減少7.58%;前三季虧損逾10億元,每股盈餘損失2.11元,股價一路溜滑梯。每一家公司對新藥開發都有前景與希望,但也都強調,「新藥開發風險高、時程長、不保證成功」,請投資人審慎評估。

新藥臨床二期未達標 安成生技股價跌逾60%、暫停舉辦法說會
安成生技(6610)旗下開發中新藥 NORA520 用於治療產後憂鬱症(PPD)之美國第二期臨床試驗,取得主要療效指標之統計數據,結果給藥組與安慰劑組之間的差異並未達到統計學顯著意義,17日股價跌幅61.76%,預計明天召開的法說會也宣布暫停舉辦。安成生技今天收在13.95元,跌22.53元,跌幅61.76%,成交量1,445張,上周五收在36.48元,成交量為832張。安成生技表示,該試驗為一項隨機、雙盲、安慰劑對照之研究,共納入九十三名成人女性重度產後憂鬱症患者,並以一比一比一的比例分派至安慰劑組及兩組不同給藥頻率的 NORA520 治療組,受試者自首次服藥起進行為期三天的住院口服治療。試驗設計採取封閉式檢定程序(closed testing procedure),以控制多重檢定 (multiplicity testing)所可能產生的統計偏差,主要療效指標(primary endpoint)則為受試者於第四天的漢氏憂鬱量表(HAM-D17)分數相較基線的差異,以及包括用藥後八天和三十天的療效等次要療效指標(secondary endpoints)。根據此次主要療效分析,兩組 NORA520 給藥組的合併結果與安慰劑組相比未達統計上顯著差異,p 值為 0.72。然而在整體安全性方面,試驗過程中未發生任何嚴重不良事件。少數患者雖有嗜睡情況,但給藥組與安慰劑組發生率相當,整體耐受性表現良好,顯示 NORA520 在短期給藥下具良好安全性。安成生技表示,從初步數據來看,在兩個給藥組有近一半的的病患達到療效反應率,但安慰劑組呈現大致相當的反應率。研究團隊正全方面評估造成此結果與預期不同的可能原因,並就各項療效指標、分層分析、藥物血中濃度等方面進行細部評估。在完成進一步分析後,安成將重新檢討並修正 NORA520 後續的臨床開發策略。安成強調,雖然本次試驗主要療效指標未達統計顯著性,但精神健康領域存在高度未被滿足的需求,團隊將持續以謹慎且科學的態度審慎進行後續工作,以確保NORA520未來開發策略合乎市場需求與法規指引。安成除了NORA520 之外,研發管線中另一項藥物AC-203正進行全球第二/三期的臨床試驗,已在全球18個國家,35個試驗中心全面進行收案,預期於明(115)年第一季進行期中分析。
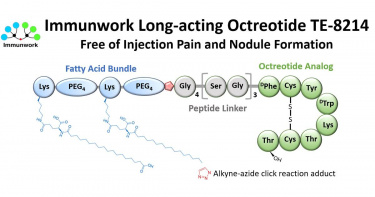
T-E Pharma旗下免疫功坊長效型奧曲肽新藥TE-8214 第一期臨床試驗證實有效改善注射不適、抑制發病生化指標IGF-1
T-E Pharma旗下之免疫功坊 (Immunwork, Inc.) 今日宣布,其自主研發的長效型奧曲肽新藥TE-8214已於澳洲順利完成第一期臨床試驗。結果顯示TE-8214具備良好的安全性與耐受性、可達成預期藥理機制,且皮下注射輕易,不產生施打部位副作用。TE-8214為免疫功坊運用專利平台技術開發之長效型奧曲肽 (octreotide) 類似物,經由在奧曲肽分子上連結含有兩條脂肪酸鏈的脂肪酸束,達成延長藥物半衰期,可應用於治療肢端肥大症與多種神經內分泌腫瘤所引致的病徵。上述兩類疾病常伴隨嚴重的內分泌失調,導致消化性潰瘍、嚴重腹瀉、氣喘、組織異常生長、關節疼痛與高血壓等症狀,若未妥善治療,將大幅影響患者的生活品質與壽命。(圖/免疫功坊提供。)隨著全球對奧曲肽藥物需求的增長,近年來相關市場規模持續擴大,預估2030年將達100億美元。現有市售與研發中的相關產品,多為高黏稠度微粒或凝膠狀緩釋劑型,須使用19G或20G的粗針頭進行肌肉 (如Octreotide LAR) 或深層皮下注射 (如Lanreotide Autogel),不僅施打困難,更易引發注射部位疼痛及結節等副作用,造成病患對治療的接受度與依從性明顯下降。(圖/免疫功坊提供。)免疫功坊創辦人兼執行長,先前發明多項創新藥物的免疫學家張子文表示:「TE-8214 完成第一期臨床試驗是免疫功坊的重要里程碑,也為肢端肥大症與神經內分泌腫瘤患者帶來新希望。TE-8214具備高水溶性,可透過30G細針頭進行皮下注射,大幅減輕患者注射時的疼痛與恐懼感。未來我們將憑藉此關鍵優勢,積極拓展全球奧曲肽市場,為患者提供更安全、更舒適的治療選擇。」TE-8214的第一期臨床試驗採雙盲、單劑量遞增設計,設有四個劑量組別 (0.6 mg、1.2 mg、2 mg及4 mg),每組納入8名健康受試者,其中6人接受TE-8214,2人接受安慰劑(生理食鹽水)。整體結果顯示TE-8214耐受性良好,僅出現輕微不良反應,未觀察到任何嚴重不良事件。常見的奧曲肽副作用為消化道不良反應,本試驗24位TE-8214受試者中,僅3人出現極輕微的消化道不適,證實TE-8214的安全性與耐受性表現優異。更重要的是,所有TE-8214受試者均未出現注射部位疼痛或結節情形,結果與安慰劑組的受試者完全相同,顯示TE-8214的劑型設計成功解決緩釋劑型的痛點問題。此外,奧曲肽類藥物主要透過抑制體內類胰島素生長因子 (Insulin-like growth factor 1, IGF-1) 濃度發揮治療效果。在本次試驗的高劑量組別 (2 mg和4 mg) 中,12位TE-8214受試者中有10位 (83%),其IGF-1濃度下降超過20%,顯示TE-8214具備顯著的IGF-1抑制效果,進一步支持其作為治療用藥之優秀潛力。目前,免疫功坊正積極展開第二期臨床試驗的籌備工作,預計於2025年第三季在台灣正式啟動。我們期盼透過未來階段的試驗推進,加速驗證TE-8214的治療潛力,拓展其臨床應用與全球市場佈局,為更多患者帶來突破性的治療方案。TE-8214與市售長效型奧曲肽類藥物的差異化比較(圖/免疫功坊提供。)關於免疫功坊免疫功坊位於國家生技研究園區,專注於開發結合標的 (T) 與效應(E) 結構單元的「T-E型藥物」,以實現兼具療效與安全性的突破性治療。公司運用自主研發的「脂肪酸束平台」技術,目前已有兩項新藥進入臨床階段,並有多項臨床前候選藥物,未來將持續推進創新藥物研發與臨床應用。聯絡資訊若您有合作洽談需求或欲了解更多資訊,歡迎與我們聯繫。電子郵件:bd@immunwork.com公司官網:https://www.immunwork.com/公司影片:https://www.youtube.com/watch?v=1owxqn08HoQT-E Pharma's subsidiary Immunwork Announces Positive Phase I Top-Line Data for TE-8214, a Next-Generation Long-Acting Octreotide, Demonstrating Favorable Safety, Tolerability, and Potent IGF-1 Suppression.·Pioneering Patient Experience: TE-8214, a highly water-soluble aqueous solution, enables pain-free subcutaneous injection with a thin 30G needle, eliminating injection site reactions seen with current therapies.·Strong Pharmacodynamic Activity: Robust, dose-dependent reduction of disease biomarker IGF-1, with 83% of high-dose participants achieving a >20% reduction, confirming therapeutic potential.·Significant Market Potential: Positioned for the US$10 billion long-acting octreotide market by addressing key unmet needs of painful injections and side effects associated with current viscous, thick-needle formulations.·Phase II Initiation and Strategic Partnering: Phase II trial planned for Q3 2025; Immunwork is actively seeking strategic collaborations to accelerate global development and commercialization.Immunwork, Inc., a clinical-stage biotechnology company developing transformative therapies, today announced positive top-line results from its Phase I clinical trial (in Australia) of TE-8214, a novel long-acting octreotide analog for the treatment of acromegaly and neuroendocrine tumors (NETs). The study met its primary objectives: TE-8214 demonstrated good safety, tolerability, and pharmacological activity, with pain-free subcutaneous administration and no injection site reactions.(This photo provided by Immunwork, Inc.)A Next-Generation Therapy for Unmet Patient NeedsTE-8214 was developed using Immunwork's proprietary fatty acid modification platform, which extends the drug's half-life and increases water solubility. TE-8214's water-soluble, low-viscosity formulation allows for subcutaneous administration with a fine 30G needle, offering a dramatically improved patient experience compared to the current standard-of-care, which requires thick, viscous formulations administered with large 19G or 20G needles that often cause significant pain and injection site reactions. This innovation addresses a critical need for safer, more patient-friendly long-acting therapies in a global octreotide market projected to reach US$10 billion by 2030.(This photo provided by Immunwork, Inc.)Phase I Clinical Highlights TE-8214's Differentiated ProfileThe randomized, double-blind, placebo-controlled, single-ascending dose study enrolled 32 healthy subjects (24 receiving TE-8214 and 8 receiving saline) across four dose cohorts (0.6, 1.2, 2, and 4 mg). Exceptional Safety and Tolerability: TE-8214 was well tolerated with no serious adverse events reported. Notably, no TE-8214 recipients experienced injection site pain or nodules—results identical to placebo with saline — demonstrating a clear advantage over existing therapies. Gastrointestinal side effects, often seen with octreotide, were minimal: only 3 of 24 TE-8214 recipients reported very mild gastrointestinal discomfort. Potent and Sustained Pharmacodynamic Activity: Octreotide drugs mainly exert their therapeutic effects by suppressing insulin-like growth factor 1 concentration in the body. In the two highest dose cohorts (2 mg and 4 mg), 10 of 12 participants (83%) achieved a >20% reduction in insulin-like growth factor 1, confirming robust biological activity and validating its therapeutic potential for Phase II studies.“These Phase I clinical trial results confirm TE-8214's differentiated profile: TE-8214 is highly water-soluble, can be administered subcutaneously using a fine needle, significantly reducing injection pain and side effects for patients,” said Dr. Tse-Wen Chang, founder and CEO of Immunwork and a pioneer of anti-CD3 (OKT3) and the inventor of anti-IgE (Xolair) for asthma and allergy. “By solving the fundamental formulation and administration challenges of current treatments, we have created a product with the potential to become the new standard of care. TE-8214's profile—combining ease of administration, superior tolerability, and strong efficacy—positions it to capture a significant share of the market and, most importantly, vastly improve the quality of life for patients.”Strategic Outlook: Advancing to Phase II and Seeking Partnerships Immunwork is preparing for a Phase II trial of TE-8214 in Taiwan, planned to start in Q3 2025, to further evaluate the efficacy and safety of TE-8214 in patients. The company is actively pursuing strategic partnerships with pharmaceutical leaders to accelerate late-stage clinical development, navigate global regulatory pathways, and maximize the commercial potential of TE-8214.TE-8214: A Differentiated Profile vs. Marketed Long-acting Octreotide Analogs.(This photo provided by Immunwork, Inc.)About ImmunworkImmunwork, based in the National Biotechnology Research Park in Taipei, develops "T-E type drugs" that combine targeting (T) and efficacy (E) moieties for transformative therapies with enhanced efficacy and safety. Leveraging proprietary fatty acid bundle technologies, Immunwork has two clinical-stage candidates and a robust preclinical pipeline, and is committed to advancing innovative medicines for global unmet needs.Contact InformationFor partnership inquiries and further information:E-mail:bd@immunwork.comWebsite:https://www.immunwork.com/Video: https://www.youtube.com/watch?v=1owxqn08HoQ

夏季飲食新寵!醫揭苦瓜9好處 研究證實助穩血糖、護腸道
「夏天就是要吃點苦,才會降火氣啊!」這句家常話不只是飲食智慧,也逐漸獲得現代醫學的支持。營養功能醫學專家劉博仁醫師近日在其臉書粉專分享了,苦瓜在現代營養學與醫學上的諸多好處。劉博仁醫師表示,苦瓜一向被中醫視為具有清熱解毒、降火氣的作用,而現代科學的研究也逐漸揭示這種「苦味」背後的實質營養價值。一項2020年發表於國際醫學期刊《Complementary Therapies in Medicine》的雙盲臨床試驗顯示,第二型糖尿病患者在連續12週服用苦瓜萃取物後,空腹血糖與糖化血紅素(HbA1c)皆有明顯下降,且未見重大副作用。這項研究指出,苦瓜所含的天然活性成分如苦瓜皂苷(Charantin)、多肽P(Polypeptide-p)以及葫蘆素類三萜(triterpenoids),不僅有助於血糖調節,也可能促進腸道健康、改善小腸末端黏膜功能,並在調節腸道屏障與降低慢性發炎方面展現潛力。除了營養成分,苦瓜在世界不同文化中也占有一席之地。以沖繩為例,當地人稱苦瓜為「Goya」,經典菜餚「Goya Chanpuru」,將苦瓜與豆腐、蛋與豬肉快炒,不僅風味十足,也成為長壽飲食的重要象徵。沖繩人長期食用苦瓜,被視為當地慢性病少、老化速度慢的可能因素之一。劉博仁說明,在台灣苦瓜品種多樣,包括乳白色、口感溫和的白玉苦瓜,以及苦味較重、營養價值更高的青苦瓜與印度型苦瓜。劉醫師指出,若以養生保健為目的,苦味較濃的品種更具價值;但若追求家常風味,則白玉苦瓜是最佳選擇。從營養學角度來看,苦瓜熱量低、營養密度高,富含維生素C、鉀、膳食纖維、葉酸與B群維生素,對於調節血糖、改善代謝症候群與減緩慢性發炎,都是不錯的天然選擇。不過料理方式也很關鍵。劉醫師建議,以快炒或汆燙方式料理苦瓜,既能保留其營養,又不會過於苦澀;相反地,燉煮過久或高溫油炸則可能破壞其中的活性成分。不過雖然苦瓜健康益處多,但並非人人適宜。孕婦、血糖偏低者及正在服用降血糖藥物者應特別留意,以免出現低血糖現象。此外,脾胃虛寒或易腹瀉者亦應避免攝取過量。劉博仁也提到,保健不僅是吃什麼,更關乎和誰一起吃、用什麼心情吃。談到母親親手烹調的香菇炒苦瓜,他感性地說,那道菜不只帶來味覺上的清爽,也喚起心靈上的踏實與幸福。劉博仁鼓勵大家,不妨趁著夏天,從一盤家常苦瓜菜開始,讓「苦中帶甘」的滋味,成為身心清爽的起點。如果家中也有拿手的苦瓜料理,不妨分享交流,因為吃對的食物,正是一種善待自己的方式。

「自閉症曙光」刺激腦右側前額下迴 可提升社交認知能力
自閉症是一種常見的神經發展疾患,會造成患者社交溝通困難、堅持度過高或侷限興趣而對日常生活產生重大影響。調查顯示,自閉症發生率約為1%-2%,且有逐年上升趨勢。遺憾的是,目前對於自閉症仍缺乏有效的生物性治療方法。林口長庚醫院最新使用Theta叢集性經顱磁刺激術刺激腦右側前額下迴,每週2次、連續8週,證實可顯著提升自閉者社交認知功能,且治療效果可維持4週。這項發現也為自閉症治療帶來曙光。進行這項研究的林口長庚兒童心智科副教授級主治醫師倪信章指出,自閉者在成長過程中可能面臨多方面的挑戰,包括人際關係、情緒調控、課業學習和生活自理等,需要家庭、學校以及整個社會的充分理解與支持。目前自閉者的協助方式以行為治療為主,但效果有限,且個別差異大。至於藥物治療,雖然可以緩解自閉者的焦慮情緒或者改善專注力,但無法改善自閉者的核心困難(社交溝通/固執行為)。關於自閉症的生物性治療方式,急需突破性的發展。近年來,林口長庚研究團隊持續關注於自閉症生物性治療方式的探索,在國家科學及技術委員會、國家衛生研究院以及長庚醫院的支持下,開展了Theta叢集性經顱磁刺激術在自閉症的應用研究,重點探索的腦區包括背外側前額葉、後顳上溝及右側前額下迴。由於背外側前額葉腦區跟執行功能、情緒調節以及固執行為相關;後顳上溝及右側前額下迴跟心智理論(將心比心的能力)相關,因此上述三個腦區被認為在自閉症的生物性治療中具有發展的潛力。其中,我們使用Theta叢集性經顱磁刺激術對於右側前額上迴的刺激,在自閉症治療方面,有重大的突破。倪信章醫師表示,重複性經顱磁刺激術是近年來備受關注的大腦介入技術,利用物理學中電場與磁場相互作用原理,以非侵入性的方式影響大腦功能,已被廣泛地應用於多種神經科與精神疾患的治療中,並在多個國家取得鬱症的治療許可。長庚大學已故的黃英儒教授改良了傳統的重複性經顱磁刺激術,開發出Theta叢集性經顱磁刺激術,大幅縮短治療時間,同時提高了安全性與可行性。長庚醫院這項研究為世界率先針對Theta叢集性經顱磁刺激術,刺激右側前額下迴在自閉症的隨機雙盲臨床試驗。該研究共招募60位8-30歲的自閉者,將他們隨機且平均分配到治療組與對照刺激組,研究結果發現,在不需要麻醉的狀況下,每週2次,每次5分鐘內,連續8週刺激腦右側前額下迴,治療組比對照組顯著提升自閉症的社交認知功能,且治療效果可維持4週。此外,這項治療模式對於改善自閉者的固執行為、情緒調節和適應功能也有治療潛力(治療組雖明顯優於對照組,但未達統計顯著效益)。治療方式安全可行,並未出現重大副作用。研究成果已發表於2024年9月國際頂尖期刊『Psychological Medicine』。倪信章醫師強調,由於自閉者的臨床表現差異顯著,因此單一腦區的成功無法適用於所有自閉者。在國家科學及技術委員會、國家衛生研究院以及長庚醫院的支持下,研究團隊將持續探索自閉症的生物性治療方式。我們期望這些累積的研究成果最終能夠獲得正式的治療許可,為全球眾多的自閉者與其家庭帶來治療曙光。關心食安、健康的朋友們別錯過~!LINE社群搜尋:健康一把抓加入我們,立刻掌握全家大小的健康與秒懂食安地雷,還有獨家健康小撇步!!【健康一把抓】→https://reurl.cc/qrypl3

順藥連吞5根跌停板、晟德也跟跌 三點緊急說明未公布試驗數據原因
晟德(4123)和旗下的順藥(6535)11月29日起才因公布新藥LT3001臨床結果,符合重大資訊標準,二檔股票停牌暫停交易,各分別收在50.6元、361.0元;12月2日起恢復交易,順藥卻連著五天苦吞跌停板,本周跌幅40.7%,交易總量約3591張。順藥6日收在214元,單日跌幅達9.89%,成交量158張,一周以來股價下跌147元,;晟德今收在43.65元,下跌0.65元,跌幅達1.47%,交易量 2,885張;一周以來股價下跌6.95元,周跌幅為13.7%。晟德順天醫藥生技(6535)於11月29日公布,根據中國大陸授權合作夥伴上海醫藥公司公告,治療急性缺血性腦中風新藥LT3001,第二期臨床試驗結果數據達初步療效;未來將積極推進與國際藥廠的授權洽談,加速全球開發計劃的進展。股價卻未因該項臨床試驗公布結果相對反應,順藥也發布重訊就投資人關注順藥公司授權中國夥伴上海醫藥於中國執行之二期臨床試驗解盲結果未揭露試驗數據、公告P值以及未來試驗數據的發表計畫,進一步予以說明三點。首先就「關於試驗數據揭露說明」,順藥表示,公司尚未取得上海醫藥提供的完整臨床試驗報告,目前僅掌握試驗數據資料。由於中國地區授權上海醫藥進行相關業務,公告內容需與上海醫藥公告一致。試驗數據的所有權歸屬於上海醫藥,因其商業考量,尚未同意揭露相關資訊。因此,在未獲上海醫藥同意的情況下,本公司無法擅自公開試驗數據。有鑑於此,本公司已於接獲上海醫藥試驗結果,立即依據上海醫藥通知與公告內容,召開重大訊息記者會以及法人說明會揭露訊息。未來亦將依上藥規劃與通知,公告相關詳細數據。在「未公告P值的原因說明」,順藥表示,本試驗為本公司首次進行多劑量第二期劑量探索研究,旨在評估藥物的安全性及探索有效劑量,主要目標為確認試驗藥物的耐受性及劑量範圍,試驗結果已達成設定目標並顯示良好耐受性。由於第二期試驗以探索性研究為主,依據藥品優良臨床試驗規範以及本試驗之統計分析計畫書,本試驗對於療效部分並未定統計假設,故無對應之療效統計 P 值,以符合國際相關法規規範。LT3001 作為全新作用機轉的新分子藥物,其與對照組在療效指標上的差異於試驗前屬未知,因此試驗設計未包含 P 值分析。為進一步探索相關療效,本公司正積極著手規劃第三期臨床試驗,以確定療效及對應的統計顯著性,並作為支持藥證申請的重要數據參考。在「未來試驗數據發表計畫說明」部分,順藥指出,未來試驗數據的發表計畫,將依上海醫藥的規劃進行。本公司雖因上海醫藥的綜合考量而未能即時公告試驗數據結果,但此情況不影響後續開發計畫的進行。本次試驗結果為支持未來開發的關鍵數據,順藥將依據現階段中國二期臨床試驗與多國多中心二期臨床試驗結果,綜合評估,審慎規劃三期臨床試驗之進行,此試驗結果之價值與運用並不受公告與否影響。順藥表示,傳統溶栓藥 rt-PA 因出血風險,僅限於中風後 4.5 小時內使用,治療時間窗極短,最新數據顯示 LT3001 對中風發作後達 24 小時內病患,展現改善神經功能潛能,且不增加出血風險,有機會顛覆黃金 4.5 小時定律,改寫中風治療史。順天醫藥生技股份有限公司根據中國授權合作夥伴上海醫藥公司之公告宣佈,LT3001在中國進行的二期臨床試驗結果,給予反應。此臨床試驗由上海醫藥在中國執行並順利完成,針對急性缺血性腦中風患者給予LT3001,評估其安全性和有效性,為後續的臨床開發提供關鍵數據支援。該臨床試驗設計於中國執行,為一項多中心、隨機、雙盲、安慰劑平行對照的二期臨床研究,總共納入300名急性缺血性腦中風患者。主要目的是評估多次給予LT3001後的安全性,包括首次給藥後90天內的不良事件和不良反應的發生率,包括首次給藥後3天內發生症狀性顱內出血、無症狀性顱內出血的受試者例數及發生率。次要目的是評估使用該藥物治療後第90天之日常生活功能改善,以功能評估量表(mRS)達到 0-1的比例做為評估指標。試驗結果安全性方面顯示,LT3001注射液總體安全耐受性良好。首次給藥後90天內的不良事件和不良反應的發生率在高劑量LT3001組、低劑量LT3001組和安慰劑組類似,且絕大多數為輕中度。三組均未發生症狀性顱內出血,僅3例受試者發生無症狀性顱內出血,且均發生在安慰劑組。療效指標方面,LT3001注射液在治療後第90天mRS達到 0-1的受試者比例上顯示出了初步療效。

順藥報喜 腦中風新藥大陸二期臨床試驗成功
晟德(4123)旗下的順天醫藥生技(6535)29日公布,根據中國大陸授權合作夥伴上海醫藥公司公告,治療急性缺血性腦中風新藥LT3001,第二期臨床試驗結果數據達初步療效;未來將積極推進與國際藥廠的授權洽談,加速全球開發計劃的進展。晟德和順藥因公布新藥LT3001臨床結果,符合重大資訊標準,28日起股票停牌、暫停交易。截至收盤,晟德、順藥分別收50.6元、361.0元。展望後市,因法說會報喜下週股價望見紅收高。新藥解盲成功,將為全球中風治療領域帶來革命性突破。順藥總經理葉聖文在法說會上表示:「全球每4人就有1人中風,很小的血栓就會造成全身很大的傷害,但打通血管的手段30年來只有2個,使用靜脈血栓溶劑蛋白藥有出血風險,就算利用影像拿出血栓,不到一半的病人能恢復生活正常。」順藥表示,傳統溶栓藥 rt-PA 因出血風險,僅限於中風後 4.5 小時內使用,治療時間窗極短,最新數據顯示 LT3001 對中風發作後達 24 小時內病患,展現改善神經功能潛能,且不增加出血風險,有機會顛覆黃金 4.5 小時定律,改寫中風治療史。順藥在中國展開第二期臨床試驗,為一項多中心、隨機、雙盲、安慰劑平行對照的II期臨床研究,共納入300名急性缺血性腦中風患者。主要評估多次給予LT3001後的安全性和有效性,包括首次給藥後90天內的不良事件和不良反應的發生率,包括首次給藥後三天內發生症狀性顱內出血、無症狀性顱內出血的受試者例數及發生率。次要目的是評估使用該藥物治療後第90天之日常生活功能改善,以功能評估量表(MRS)達到0-1的比例做為評估指標。試驗結果顯示安全耐受性良好,為 LT3001 在急性缺血性腦中風領域的後續開發奠定關鍵數據支持。
嘉惠4千名癌友!健保10月擴大「這1類肺癌標靶藥」給付 年省近115萬
為提高肺癌存活率及降低死亡率,與國際治療指引接軌,提供更好的治療選擇,中央健康保險署自113年10月起擴大給付治療肺癌表皮生長因子受體(EGFR)基因突變的第三代標靶藥osimertinib成分藥品,適用對象不再限制需腦轉移,及除原EGFR Exon 19 Del基因突變,新增EGFR Exon 21 L858R基因突變,並由原給付於第4期擴大至第3B及3C期肺腺癌病人的第一線治療,預估新增嘉惠4千名肺癌病友。肺腺癌EGFR基因突變最常見 osimertinib成分藥品延長存活率肺癌已連續14年為我國癌症標準化死亡率最高,且110年起亦為癌症發生人數第1名,肺癌以非小細胞肺癌中之肺腺癌發生率最高,約占所有肺癌的70~80%,而肺腺癌以EGFR基因突變最常見,約50~60%的發生率,且約90%為 exon 19與exon 21。根據一項osimertinib成分藥品第三期雙盲、活性藥品對照、隨機分派的FLAURA試驗,納入具EGFR Exon 19 Del或Exon 21 L858R之局部侵犯性或轉移性NSCLC,結果顯示osimertinib成分藥品相較標準EGFR-TKI組,統計上顯著延長無惡化存活期中位數8.7個月,降低54%發生疾病惡化或死亡風險;顯著延長整體存活期中位數6.8個月,降低20%發生死亡風險。健保給付與國際治療指引接軌 助肺癌病友精準用藥健保署致力將具治療效益之藥品納入健保給付及接軌國際治療指引,在侵犯性或轉移性NSCLC且具EGFR基因突變的第一線治療策略,於健保審議藥品給付參考美國國家癌症資訊網(NCCN)2024年第三版非小細胞肺癌(NSCLC)指引,其中osimertinib成分藥品分屬Category 1(證據等級高);另三大主要醫療科技評估組織加拿大(CADTH)、澳洲(PBAC)及英國(NICE)已給付該藥用於未曾接受過治療且具EGFR突變之局部侵犯性或轉移性(第IIIB或IV期)NSCLC病人之第一線治療。經過醫藥界、付費者代表及病友團體的共同努力,同意osimertinib成分藥品以簽訂藥品給付協議方式擴增給付規定。健保給付年度藥費最高 肺癌標靶藥擴大給付健保署石崇良署長表示,本次擴增給付之osimertinib成分藥品,歷經3次與廠商協商,讓藥品在健保有限資源下,得以依實證做有效益的給付。平均每位病友每年節省約115萬元藥費,並新增挹注年藥費約50億元,預估單年最高總藥費支出達91億元,健保史上給付單一藥品年度費用最高之藥品。

高普考1萬考生「只錄取300人」 過來人揭關鍵
許多人認為公職相對於私營企業工作來說,擁有較高的工作穩定性,不易因為經濟波動而失業,因此公務人員也被稱為「鐵飯碗」。然而大家都想考,但職缺卻沒那麼多,日前有考生發現,「一般行政類別」共有1萬多人報考,但總缺額卻只有300多人,讓他感嘆,「這…到底要人怎麼考嘛」。該名網友在Dcard以「一般行政也太多人報考」為題發文表示,自己在人數公布的當下,沒有急著看公告,結果今天一看真的驚呆了,他指出,高考的報考人數有4千多人,普考的報考人數6千多人,但錄取人數分別是100多和200多,且還是增列之後,這也讓他感嘆,「這…到底要人怎麼考嘛」。文章曝光後,不少人紛紛留言表示,「很多都是炮灰啦,不用在意報名率,要怕的是來刷單位的,像我已經二刷成功,換過三個單位了,認真覺得考上後比較辛苦」、「大概一半都是炮灰」、「國考永遠都是前面幾成的人在競爭而已,扣掉缺考、練筆、高普同時報考重榜之類,其實對手真的沒想像中多,大概就5%至10%左右的人在爭取名額罷了」、「司法行政來了近1400人,取7人」。但也有人認為可以選擇別的類別,「看到一般行政的單位跟業務後,就不想考一般行政了」、「那就別選一般行政啊,就一堆人去補習班諮詢,他們首推就是一般行政,然後讓人變萬年考生,每年才有固定收入」、「不只是補習班,那些教授學者及補教老師都藉此賺得盆滿缽盈。但對於用人機關而言,這些考科及題目應該是不敢恭維」、「公務人員考試是一個利益非常龐大的市場,為了要保護、維持這些教授學者、補教老師及補習班業者的利益,考選雙盲絕對不會去更動、改變的」。

現代人普遍缺乏維生素嗎?一定要補充? 醫:缺的是這個
科學漢醫:缺少的不是維生素,是需要接地氣與親近大自然門診病人常常詢問我「需要吃維生素嗎?我會缺乏維生素嗎?需要補充什麼維生素?」其實,大部分的醫師對於上述的問題,寧可讓病人多服用維生素,也不願意正面回答,原因在於缺乏維生素的症狀多不勝數。然而很多人補充維生素之後,卻還是出現這些症狀,到底是怎麼回事呢?維生素很多皆是抗氧化劑,好比維生素E。二十年前維生素E可是炙手可熱的商品,也是學術上認為非常重要的一個成分。但是經過一項長期的臨床雙盲研究之後,才發現補充維生素E,非但不能達到抗氧化的作用,反而容易產生心臟病,因此服用維生素E的流行也嘎然而止。那麼現在流行補充什麼呢?維生素D!可是維生素D 不是曬太陽就可以了嗎?到底要不要補充維生素D呢?要不要讓維生素 D 一直維持很高的濃度呢?這和維生素E是相同的問題,維生素D與維生素 C一樣,主要是抗氧化劑。抗氧化劑若是要起作用,就得在一定的電位,才能起作用。好比維生素D,如果沒曬太陽,它根本不會產生活性作用,因此,它與外在環境息息相關。很多人即便補充了大量的維生素D,血液中維生素D含量很高,可是卻無法作用,為什麼?因為它沒辦法轉化,無法轉化成產生活性作用的成分。同樣地,維生素E亦是如此,當你補充大量維生素E,雖然它是抗氧化劑,可是身體的電位是處於無法還原的條件下,它如何能夠發揮抗氧化的作用呢?總之,若是你的身體處於缺氧缺能量的狀況下,由於氧化還原電位(Redox potential)的改變,所有的抗氧化劑皆氧化了,沒有辦法再提供吸收電子的抗氧化能力。這時候補充再多的維生素D或E,不但達不到抗氧化的功效,反而會衍生出其他的問題,例如維生素E,過量造成心臟疾病風險。為什麼我一有空時便要去接地(earthing),一接地時身體的電位便會完全改變,正與負顛倒過來。一般人常常覺得自己渾身不對勁,少這少那,其實不是少了什麼物質,而是他身體的能階處在一個不一樣的狀態,這時候應該更親近大自然,曬曬太陽,赤腳接地,呼吸新鮮空氣,甚至像貝多芬一樣享受月光。為什麼到了假日,大家喜愛往郊外跑,導致處處塞車。其實是由於我們生活的環境不好,人們如同關在人造的監獄裡,等到假日才能放風啊!沒有好的空氣,沒有好的水,甚至沒有好的電位,人怎麼會健康呢?美好的大自然,才是我們最缺乏的維生素!為什麼練功會走火入魔?大家皆聽過「走火入魔」,但練功因何變成如此呢?主要關鍵在於「氣有餘便是火」。當練功者頭部的氣血失去平衡,造成不可逆的傷害,損害到腦部細胞功能,進而產生神經或精神的問題。《內經》説「久則增氣,物化之原。氣增而久,夭之由也」請大家務必牢記,這一概念不只適用於藥物的副作用,也適用於氣功。比如幻聽病患的脈象,我們可以發現病患頭部高頻經脈,氣血嚴重不足,相似的脈象也會出現在憂鬱症、失智與重聽的病患。「氣增而久,夭之由也」提醒我們,身體自身有代償的機制,用來平衡各種不同的外在作用,使身體趨於和諧,例如耐受性(Tolerance)這樣的機制,當人們重複一直服用同樣的藥,身體對藥物的反應便會降低。「走火入魔」便是破壞了這樣的身體代償機制。練氣功為什麼會破壞身體自有的代償機制?原因在於練功者沒有正確選擇適合自己當下身體狀況的功法,也就是「虛虛與實實」,補到邪氣侵襲的經脈臟腑,或瀉到虛的經脈臟腑。治療的方法應該特定增強這些不足的經脈,而非增加心經與肝經的負擔。但一般的治療或氣功,若沒有先正確診斷練功者的體質或潛在的問題,冒然練功或服藥治療,便容易發生肝火或心火上升的問題,最常見的問題莫過於「甩手」,這是最容易得氣的功法,也是最容易走火入魔的功法。二十多年前盛行的*丹功,入門的甩手造成許多人高血壓,甚至中風的困擾;包括教主與教練皆不能倖免,後來便消聲匿跡,從紅極一時到乏人問津。特別是外感肺經時更是不能甩手,不但補不到肺氣,還會讓邪氣侵襲全身,「久則增氣」明白地告訴我們,透過同樣的頻率提升共振,便能增強某一特定諧波器官的氣血循環,進而促進功能。習練其他的功法也必須注意上述這些問題,比如站樁,當病患頭部缺血,勉強站樁,便導引氣血到下半身的兩腿,固然補到腎氣,然而頭上缺血則更雪上加霜,繼續習練,不是加重心臟負擔,就是頭暈休克暈倒。現在醫師可以透過經脈血壓計,便能達到自古神醫才有的境界,也就是「內視經脈臟腑」的神通。練氣功想受益匪淺,不走火入魔,可以先諮詢這些醫師。本文摘選自《科學漢醫的養生》,布克文化出版。

「K他命」用對就成救命藥 振興、北榮、陽交大研究:可降一半憂鬱自殺風險
台灣自殺死亡率最高點為2006年19.3人/10萬人,佔死因第9位,逐漸下降至2014年15.1人/10萬人,而近年有回升現象,2022年為16.2人/10萬人,如今有研究顯示,以毒品廣為人知的K他命(Ketamine),透過醫學上適量使用可以在短時間內產生抗憂鬱療效。振興醫院今上午舉行記者會公布「K他命化身拯救自殺超級藥物」研究結果,這項由振興醫院與台北榮總、陽明交大研究團隊合作10年來的研究,最新成果顯示,重度憂鬱症患者注射K他命後,半數患者自殺風險下降達50%,且重複注射療效更佳,今年5月登上國際期刊。根據振興醫院精神醫學部醫師蘇東平指出,研究團隊在2017年發現,每公斤體重注射0.5毫克的極小劑量K他命,數小時內就有效果,可持續1到2周,補足傳統抗憂鬱劑發揮效果的空窗期。研究團隊收案84名具有嚴重自殺傾向的難治型憂鬱症患者,採隨機雙盲試驗,其中42人注射每公斤0.5毫克的K他命,另外42人注射不具有抗憂鬱效果的安眠藥,結果顯示K他命抗憂鬱療效可維持10到14天,抗自殺療效可維持5到7天。這些收案對象中有半數繼續第二階段的開放性K他命治療,每周給予一次注射,連續2周。蘇東平指出,追蹤至第21天時,仍有半數患者反應良好、自殺風險下降,亦有15%到20%患者部分緩解,但仍有25%屬於難治型自殺患者。蘇東平表示, 美國2006年研究發現,使用K他命可讓憂鬱症狀在1周內大幅下降,這項結果鼓舞了全世界,過去針對重度憂鬱症患者,傳統會給予抗憂鬱劑治療,但這個藥物大約2到4周才有效果,在藥效發揮的這段空窗期,常常會有憾事發生。根據研究,台灣1997年因自殺導致的經濟損失為185億元,占GDP的0.22%,到了2007年增加至325億元,占GDP的28%,增幅高達75%。蘇東平也表示,台灣自殺死亡率在2006達到高峰,後來衛福部成立自殺防治中心後有逐漸下降,但最近一兩年又回升,尤其青少年顯著增加;如何緊急處理自殺個案,成為精神科重要策略。不過蘇東平也提醒,K他命是一種短效麻醉劑,每公斤體重注射5至10毫克劑量,但藥物濫用者為此劑量數十至百倍以上,研究是強調K他命治療是有時間和適當性,因此有相關問題的民眾,一定要經由醫師診斷評估使用。CTWANT關心您:再給自己一次機會自殺防治諮詢安心專線:1925生命線協談專線:1995吸毒有害健康,毒品危害防制中心諮詢專線:0800-770-885

康霈局部減脂新藥二期試驗獲美FDA核准 股價聞訊大漲15%
康霈生技(6919)公告旗下新藥用於減少皮下脂肪(非手術局部減脂)CBL-514二期臨床試驗已獲美國FDA核准執行,此臨床試驗預計於美國、加拿大和澳洲共100位中、重度腹部皮下脂肪堆積受試者。2024年第二季取得臨床統計結果,進行中的授權談判已在持續進行中,今日盤中股價一度大漲15%,股價衝上興櫃以來最高價195.5元。康霈表示,美國FDA針對CBL-514減少皮下脂肪的三期臨床試驗主要評估指標是減少腹部皮下脂肪堆積等級(AFRS)之療效,因此該臨床改用核磁共振更精確的評估治療後減少的皮下脂肪量,以便模擬並取得產品未來關鍵三期臨床試驗的試驗設計條件。若本試驗案完成且主要終點達標,CBL-514將於2024年啟動減少皮下脂肪之全球多國多中心三期樞紐臨床試驗申請。此次FDA核准執行的二期雙盲臨床試驗主要目的為評估CBL-514注射劑用於減少皮下脂肪的療效、安全性與耐受度;將招募100位中、重度腹部皮下脂肪堆積的受試者,試驗分為CBL-514組與安慰劑組。此試驗是多國多中心、雙盲、隨機分配、安慰劑組對照的臨床試驗,且為加快收案速度,將於美、加、澳洲3國進行收案,試驗中心包含3國多位全球知名的PI加入,可同步為產品推進三期樞紐試驗與未來上市做準備。預計今年Q2開始收案,並計畫在2024年Q2取得臨床統計結果。此外,康霈進一步表示,CBL-514目前進行中的授權談判仍將持續,不需等到二期臨床試驗結束。康霈執行長凌玉芳表示,CBL-514注射劑是一種505(b)(1)全新小分子新藥,能誘導脂肪細胞凋亡,可經由注射方式精準減少治療部位脂肪,且不會造成其他組織細胞壞死或損傷,也不會對神經系統、心血管或呼吸中樞造成副作用。根據Grand View Research 2021年調查,2030年全球醫美市場預估為3321億美元;Deloitte中國身體塑形市場行業發展白皮書推估,全球局部減脂市場將超過1000億美元,且現有治療方式療效不佳或副作用大。目前局部減脂75~80%採用侵入性的外科手術,包含抽脂手術與腹部整形術,但外科手術具有嚴重副作用與後遺症,以及致死的高風險。而局部減脂產品的主要用途為減少治療部位的皮下脂肪而非減輕體重,目前局部減脂 75-80% 採用侵入性的外科手術,包含抽脂手術與腹部整形術,不過外科手術具有副作用與後遺症等。凌玉芳表示,並非所有三期臨床都可以申請新藥查驗登記(NDA),關鍵三期臨床試驗,才是攸關一個新藥最後能否獲得美國FDA或歐盟EMA批准上市的臨床試驗,為了降低風險,要求至少要有一個雙盲臨床二期試驗在療效指標達到主要終點統計差異,且與試驗設計高度模擬並取得更多樣且充分的療效數據,以大幅提升未來樞紐試驗成功達標的可能性。

北極星新藥ADI-PEG 20獲美FDA同意軟組織肉瘤三期人體臨床試驗
北極星藥業-KY(6550)今天(21)表示,收到美國食品藥物管理局FDA同意軟組織肉瘤三期臨床試驗審查(IND)之通知,採用代謝療法新藥ADI-PEG 20合併Gemcitabine及Docetaxel治療平滑肌肉瘤(leiomyosarcoma),該試驗為隨機、雙盲、多國多中心,預計收案人數為300位。ADI-PEG 20為研發中治療肺間皮癌新藥。該案主要評估指標為疾病無惡化存活期(Progression Free Survival),次要評估指標為整體存活期(Overall Survival)。北極星藥業-KY並進一步說明市場現況,稱軟組織肉瘤是由一群少見腫瘤所組成的族群,包含非常多種組織型態;因此,它的治療常常會因人而異,必須依腫瘤大小及位置、組織型態以及病人身體狀況來制定個人化的治療方式。平滑肌肉瘤(Leiomyosarcoma)是軟組織肉瘤中最為常見的兩種組織學病理類型之一,但是能夠合理地平衡療效及安全性的可選擇性治療到目前為止,仍然有限。目前公司合作夥伴由華盛頓大學醫生Brain Van Tine在2021年ASCO線上年會發表軟組織肉瘤二期試驗結果,顯示參與試驗的受試者為75人,其中有6位腫瘤完全消失,基於此正面數據,公司將主導推進軟組織肉瘤之三期試驗,持續推進加快ADI-PEG20代謝療法新藥於軟組織肉瘤臨床的應用。

醫界揭密2/補充保健品「先考慮利弊」 魚油吃太多恐釀心律不整
腎臟科醫師王介立在臉書PO文,呼籲家長不必買太貴的生技營養品給孩子,也表示許多保健品的功效不如預期,部分甚至可能有反效果,所以一定要先考慮利弊再補充。以魚油為例,雖然普遍認為補充魚油可預防心血管疾病,卻也有研究指出,若是補充過高劑量的魚油保健品,恐怕反而會引發心律不整。王介立說,「當我講『預防』及『增加』時,我強調的是因果關係,要確定療效的因果關係,最理想的方法是透過標準化的雙盲隨機分派臨床試驗,這在數學上是可以證明的,也是生物統計學的最基本專業。舉例,無數觀察研究證實了多吃海產與較長的壽命有相關,但,各位知道近幾年來多少個魚油的臨床試驗都敗下陣來嗎?」不只如此,長期攝取高劑量的魚油,可能會增加心律不整的機率,嚴重可能導致中風、猝死。2021年國際期刊《Circulation》發表研究成果,將8萬多人分為兩組,一組每天服用1克以上的魚油、另一組則低於1克,結果發現服用1克以上的魚油受試者,出現心律不整的機率較高。王介立提醒,大部份的營養補充品,補充前都需要思考利弊得失,幾乎不存在那種「無腦吃」補品,能夠無腦爽吃的,真的只有健康原型的食物。王介立不否認自己也吃保健品,但大多都是「吃心安」,而且不吃昂貴的保健品。舉例來說,王介立跟老婆都吃維生素D3,但是每周才吃一顆,算起來可吃60週(超過一年),而這罐維生素D3只需要台幣437元。保健品並非萬靈丹,例如魚油一向被視為可預防心血管疾病,但最新研究卻證實過度攝取反而增加心律不整的機率。(圖/123RF)王介立也買過益生菌產品,自己跟小孩偶爾會吃,但自從他跟家人開始吃大量蔬食後,就幾乎沒遇過腸胃問題,因此也很久沒吃了。王介立坦言,自己採行健康飲食也不到2年,以前經常亂吃,所以孩子也跟他一樣愛吃零食。如今王介立開始吃得更健康,當然也希望孩子加入,但他認為疏導與禁止更有用,所以不會刻意禁止孩子買垃圾食物,但他會經常解釋健康飲食的概念,然後花很多時間去舉例超商中可以買到哪些較高營養價值的食物,剛好他就讀國一的兒子自然課在上生物學,其實孩子是有興趣聽的,所以也會反問很多。王介立發現,這樣做其實頗為有用。因為,孩子不只一次跟他說,剛才回家的路上稍微思考了一下,最後決定少買一些高糖份食品,改買以澱粉、蛋白質、膳食纖維及天然脂肪為主的食物。只要多吃天然蔬果、原形食物,就能獲得均衡的營養,那又何必去吃膠囊、粉末的保健食品呢?

小四女童長不高 醫檢查揭密「這2大錯誤是關鍵」
國小四年級的小瑜在學校例行的健康檢查中發現,她的身高和同班同學差了一大截,小瑜的媽媽很擔心她長不高,聽說中醫有轉骨的方法,經轉介紹後,至衛福部台中醫院中醫科門診進一步諮詢。媽媽詢問:「聽說中藥可以幫助小朋友轉骨,不知道療效如何?外面有很多在賣轉骨方的廠商,我可以直接購買來給小瑜服用嗎?」衛福部台中醫院鄭惟仁醫師指出,在確認小瑜的第二性徵出現的時間後,並沒有發現特別的異常,於是開了X光檢驗單,發現小瑜的骨齡是9歲,骨骼發育比實際年齡慢了一年,所以難免會比同學矮上一截,經過詳細的問診後發現小瑜的胃口很小,每餐只吃半碗左右,也有明顯的挑食習慣,下課後也因為需要補習,常常要拖到10~11點才能上床睡覺。鄭惟仁醫師表示,影響兒童的身高有「先天」與「後天」兩大因素,先天的因素就是父母親的身高,如果爸媽的身高都很高,小朋友自然容易長的高些,反之若爸媽的身高都比較矮小,孩子身高也會受影響。鄭惟仁說,「營養的攝取」對兒童的成長至關重要,不僅食量需要足夠,營養素也要均衡不能偏廢,建議家長可以參考國健署「我的餐盤」為原則,如「每天早晚一杯奶、豆魚蛋肉一掌心」都是很簡單容易記誦的口訣,每種營養素都提供長高必不可少的協助,除了大家熟知的鈣質以外,蛋白質的補充也很重要,因為肌肉與骨骼的原料正是蛋白質。有些家長認為要給小朋友健康的飲食習慣,把所有的料理都煮的的少鹽、少油、很清淡,結果小朋友一點胃口也沒有,從經驗來說,一般兒童喜歡口味較重的飲食,如咖哩飯、肉燥飯等,從中醫的角度來說,在料理中加入適量的辛香料或酸味不僅能增添料理的風味,也能達到促進食慾的效果。另外「睡眠」是影響身高重要的後天因素,鄭惟仁說,深度睡眠能夠讓大腦分泌較多的生長激素來幫助骨骼成長,晚上10點到凌晨2點是生長激素分泌的高峰,應盡量讓兒童在這個時段處於熟睡的狀態,一般來說上國小的兒童每日應睡眠9~11小時,國中則為8~10小時,所以越晚睡,分泌的生長激素就越少,對孩子的身高影響越大。 鄭惟仁說,根據近期國際隨機雙盲研究報導,身材矮小的兒童在規律服用特定的中藥24周後,結果發現能夠使骨骼生長速率增加,且不會使骨齡超前,雖然實際的機轉仍不明確,但可能與血中生長激素的代謝物(IGF-1)增加有關;坊間的轉骨方多含有「補腎養血」等藥物來促進成長,這類藥物有一定的使用時機與規範,並非所有的情況都適合使用,鄭惟仁呼籲,應避免盲目購買,建議應諮詢合格中醫師的意見並作詳細的檢查較為妥當。鄭惟仁醫師請小瑜嘗試改善的飲食習慣與增加睡眠時間,並開立一些促進食慾與幫助生長的藥物,每個月定期回診追蹤身高與評估療效。在規律服用幾周中藥後,小瑜的食慾慢慢增加,身高也緩緩的增長,半年後再追蹤一次骨齡,看看是否有逐漸追上同齡兒童的身高。
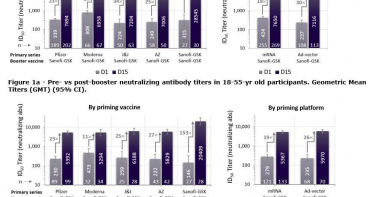
「2大藥廠合作」新冠疫苗傳捷報 中和抗體最高提升153倍!
賽諾菲與葛蘭素藥廠共同研發的重組蛋白新冠疫苗,由賽諾菲提供重組蛋白技術及執行臨床試驗,葛蘭素史克提供AS03佐劑,共同研發而成,在第三期臨床試驗中顯示出非常正面的結果,也即將向美國與歐洲監管機構提交審核,將為基礎與追加劑市場增添強力生力軍,造福全球人民。賽諾菲與葛蘭素疫苗是重組蛋白疫苗,使用美國國家衛生研究院S2-P專利抗原並採用葛蘭素史克專利佐劑AS03,在一項多中心、隨機分配、雙盲、安慰劑對照、第三期臨床試驗 (VAT08)初步分析顯示,預防有症狀感染保護力達57.9%,預防重症與住院保護力達100%。(收案期間含括多種主流變異病毒株)另外, VAT02 二/三期延伸性臨床試驗也顯示,賽諾菲與葛蘭素重組蛋白疫苗作為自身或其他機轉疫苗的追加劑,皆可產生明顯的免疫反應。此重組蛋白疫苗在做為基礎疫苗接種 (primary series),對新冠病毒有症狀感染保護力可達 57.9%,這對當今各主要變異病毒株預期的疫苗保護力相仿。臨床試驗結果也顯示對預防新冠重症和住院風險的有效性達100%,在預防中度或重度疾病風險方面有效性達75%,安全性良好且達標。臨床試驗指出,此重組蛋白疫苗在做為基礎疫苗接種並作為追加劑 (booster)時,追加後的中和抗體提升84 至 153 倍。在接種兩劑其他廠牌的新冠疫苗 (mRNA或腺病毒載體疫苗)之後,施打此重組蛋白疫苗作為追加劑,可以將中和抗體提升18至30倍。並且重組蛋白疫苗能在正常冰箱溫度下儲存,針對仍有大量人口尚未接種疫苗的開發中國家,更容易處理與運輸。賽諾菲疫苗事業部執行總裁Thomas Triomphe 表示,「我們對這樣的數據結果非常滿意,當今疫情仍深具挑戰,但我們看見這個共同研發疫苗展現強大的有效性,並且在此期間,全球並沒有其他第三期臨床試驗有參與如此多的變異病毒株,而這些有效性數據與其他已授權疫苗的臨床數據接近。」香港台灣賽諾菲疫苗事業部總經理詹靜如表示,「我們樂觀其成看見目前臨床試驗正面結果,也非常期待能有機會為台灣的公共衛生,共盡一份心力。」香港台灣賽諾菲疫苗事業部醫學事務處處長葉庭瑜醫師表示,「這一個不同機轉的新冠疫苗,期待能造福對目前基礎或追加劑無法耐受的族群,早日達成全體接種,離疫情終結更近一步。」追加前與後的血清抗體值幾何平均效價(Geometric mean titers, GMT) (上圖是18-55歲,下圖是56歲以上)。(圖/賽諾菲提供)

國鼎新冠口服藥解盲成功 股價飆漲67.5%…開盤8分鐘後暫停交易
興櫃新藥公司國鼎(4132),昨(5)日召開重大訊息說明會,宣布其新冠肺炎新藥Antroquinonol(Hocena)二期臨床試驗解盲成功,國鼎董事長劉勝勇並表示將在今年4月向美國提出緊急授權(EUA)申請。受此好消息激勵,國鼎今日股價一開盤就直上237元,漲幅高達67.55%,因符合暫停交易標準,目前已暫停交易。國鼎表示,該公司接獲國際CRO(委託臨床機構)labcorp Drug Development通知,Antroquinonol於美國、秘魯及阿根廷所進行人體二期臨床試驗,去年第4季完成所有受試者的收案和治療,總共收治124位病患。該試驗是採隨機、雙盲、安慰劑對照研究,用於因新冠肺炎而住院的輕度至中度患者之安全性和有效性的驗證研究,患者一天兩次口服100mg Antroquinonol或安慰劑,聯合標準治療(SoC)總共14天。國鼎新冠新藥試驗數據顯示,主要評估指標(時間14天)的康復率(recover ratio),第14天用藥組患者的康復率是97.9%,用藥組在第28天所有病人都沒有死亡、也沒有呼吸衰竭,康復率是100%;次要評估指標(時間範圍為28天)部份,加護病房重症用藥組病人中位數治療天數和安慰劑組中位數治療天數相比,用藥組的治療時間縮短了9.5天。另外,用藥組的病人中位數住院時間為四天,清除病毒時間中位數天數為14天。劉勝勇表示,整個二期臨床試驗將在今年4月完成報告,但公司將先針對分析數據以及研發相關文件,在今年元月份先向美國食品藥物管理局(FDA)申請緊急授權前會議(pre-EUA Meeting),待全部文件準備完成備齊後,目標4月向美國FDA提出EUA申請。為了取得正式藥證,國鼎也將向FDA同步申請三期臨床試驗,預計要啟動歐洲等多國逾50個臨床試驗中心的臨床試驗,後續投資金額約5,000萬至8,000萬美元。國鼎昨日召開重大訊息說明會,宣布新冠口服藥解盲成功。(圖/翻攝自櫃買中心官網)
國產新冠新藥「康復率100%」 國鼎生技:向美申請EUA
國鼎生技今下午兩點公布新冠肺炎(COVID-19)研發新藥Antroquinonol二期臨床試驗分析數據,試驗採隨機、雙盲、安慰劑對照研究,用於因新冠肺炎而住院的輕度至中度患者的安全性和有效性的驗證研究;最新試驗結果顯示,第14天用藥組的患者康復率是97.9%,若用藥組在第28天,康復率達100%;國鼎生技表示,後續將依計畫將二期臨床試驗分析數據以及研發相關文件送交美國FDA,並申請緊急授權(EUA)審查。這項新藥試驗是於美國、秘魯及阿根廷所進行的人體二期臨床試驗,於2020年10月16日開始第一位受試者接受治療,並於2021年第4季完成所有受試者的收案和治療,總共收治124位病患。國鼎生技新冠肺炎新藥的二期臨床試驗是採隨機、雙盲、安慰劑對照研究,用於因新冠肺炎而住院的輕度至中度患者之安全性和有效性的驗證研究,患者並將接受一天兩次口服100mg Antroquinonol或安慰劑,聯合標準治療(SoC)總共14天;試驗結果顯示,在第14天用藥組的患者的康復率是97.9%,此外,用藥組在第28天所有病人都沒有死亡、也沒有呼吸衰竭,康復率是100%。在安全性方面,國鼎生技表示,本次人體試驗的整體不良反應監測顯示,口服的Antroquinonol確實展現出非常良好的安全耐受性。

6歲遲緩兒四肢無力 雷射針灸搭配早療提升肌力
6歲妹妹自出生起四肢無力,語言與動作發展遲緩,無法自行移位,求診中國醫藥大學新竹附設醫院鄒曉玲醫師,每次就診都需要媽媽抱下車、坐推車移動,經過長期早療課程與針灸治療,隨後又搭配雷射針灸數個月之後,某一天回診時突然可以自己扶著車門走下車,給媽媽一個超大的驚喜!6歲妹妹隨著下肢肌力持續進步,從跪爬著移動逐漸進階到可以扶站移動。鄒曉玲醫師表示,門診中一些4-5歲小朋友,因為開始讀幼稚園,被老師發現語言發展落後,表現狀況為語言詞彙少、理解力不足、聽不懂指令或與其他小朋友的溝通互動不足,父母親帶來尋求中醫協助,經過數週至數個月頭皮針的治療,觀察到小朋友的口語表達能力開始提升,詞彙量逐漸增加,也比較能配合大人的指令動作,與別人溝通互動的表現增加,開始會在學校交朋友。鄒曉玲醫師指出,發展遲緩在中醫兒科屬於「五遲」、「五軟」的範疇,主要歸因於先天稟賦不足造成小朋友在肢體活動與語言表達方面的落後;治療方面針對病因選擇補益肝腎氣血的內服中藥,可以促進身體整體機能的提升,再搭配頭皮針給予大腦內部主管語言、運動或情緒等相應功能區塊進行針刺以活化腦內神經。一篇收案132名腦性麻痺伴隨語言發展遲緩兒童的隨機雙盲研究也顯示,語言復健搭配針灸治療組的小朋友進步幅度比單純接受語言復健的小朋友明顯。鄒曉玲醫師表示,相較於傳統針灸,怕痛、畏針的人也可以選擇無痛感且非侵入性的雷射針灸,雷射針灸是以低能量的雷射光束在穴位上進行固定能量和頻率的照射,能促進體內粒線體合成,增加能量來源,啟動內分泌調節,達到抗發炎及恢復血液循環效果。
疫苗混打有望?台大率先完成「AZ+莫德納」 結果出爐
新冠疫情仍未趨緩,全球正進行疫苗接種,除了考量是否要追加第3劑,混打也成為趨勢。國內目前尚未開放一般民眾混打,不過台大醫院及長庚醫院先前投入不同廠牌的疫苗進行混打實驗,包括AZ、莫德納、BNT,以及國產高端疫苗等,目前台大醫院「AZ+莫德納」混打組已初步完成。針對台大醫院的「AZ+莫德納」混打試驗,中央流行疫情指揮中心專家小組召集人張上淳表示,此案共收200人,都已完成第2劑施打後28天的抽血追蹤,初步結果顯示抗體比2劑打AZ者還要好,也和國外「AZ混打BNT」的保護力數據差不多。另外,台大正在進行中的混打試驗還包括「莫德納+高端」、「高端+BNT」及「AZ+BNT」。至於「莫德納+高端」混打試驗,將採隨機雙盲方式將受試者平分為2組,一組接種莫德納,一組混打高端,並在接種第0、14、28天,以及3個月和6個月抽血檢驗中和抗體效價,初步結果最快月底出爐。台大醫院已完成「AZ+莫德納」混打試驗。(示意圖/翻攝自pexels)長庚醫院也有2組混打研究正在進行,指揮中心有開放第一類醫事人員混打「AZ+莫德納」,因此只要針對有混打的醫事人員做中和抗體檢驗即可,此外長庚也申請「AZ+高端」混打試驗研究,總共收案100人,預計月底前完成接種,並在28天後第一次抽血、半年後最後一次抽血再驗中和抗體,預計追蹤到明年5月。衛福部桃園醫院也展開第3劑接種高端疫苗試驗,以接種過2劑AZ的人再打高端,預計收案200人,已經超過半數人接種,將持續觀察3個月,再檢測中和抗體效價。