FDA
」 FDA 美國 台股 新藥股 AI
朴春突爆隊友Dara涉毒!親筆信重提2010年事件 貼文3小時急刪
南韓女團2NE1主唱朴春(Park Bom)近期因健康因素暫停部分演藝活動,但相關爭議仍持續發酵。朴春3日突然在社群平台Instagram公開一封親筆信,重提2010年曾引發關注的藥物事件。她在信中表示,當年被外界質疑的藥物其實是治療注意力不足症(ADD,Attention Deficit Disorder)的處方藥,並否認吸毒指控。Dara(Sandara Park)則被朴春在信中點名。朴春聲稱,當年藥物事件之所以被放大,是因為Dara涉及毒品問題,為了掩蓋相關事件才將她塑造成「吸毒者」,貼文曝光後迅速在韓國網路引發討論。南韓女團2NE1成員朴春公開親筆信,重提2010年藥物事件引發討論。(圖/達志/美聯社、IG@newharoobompark)朴春在信中以「致國民」為開頭表示,希望能向外界說明自己的立場。她在信中指出,當年被提及的藥物「Adderall(阿得拉)」是一種治療注意力不足症的精神科處方藥,已獲得美國食品藥品監督管理局(FDA)批准使用。不過該藥物在韓國被列為管制或禁止藥品,因此當時事件曝光後引起廣泛關注。朴春在信中表示,自己是注意力不足症患者,當年使用相關藥物是出於治療需求。事件發生於2010年,當時朴春透過國際郵件將該藥物寄回韓國,但未向海關申報,也未取得食品藥品安全處許可,因而引發爭議。檢方之後確認她使用藥物的目的為治療需求,最終作出緩起訴處分。Dara遭朴春點名指控涉毒,相關說法已被否認。(圖/達志/美聯社)此外,朴春在手寫信中提出指控,聲稱當年的風波與團員Dara有關,甚至表示對方因涉毒問題而試圖將責任轉移到自己身上。她寫道,自己因此被外界塑造成「吸毒者」。她指出,當時Dara涉及毒品問題,為了掩蓋相關事件,才將她塑造成吸毒者。朴春寫道,當年事件讓她承受巨大壓力,「那時候我感覺自己好像死過一次」。朴春也在信中點名多名與事件相關的人物,包括前經紀公司YG娛樂高層梁鉉錫、製作人Teddy以及團員CL(李彩麟),並表示希望相關人士不要再對外發表不實說法。不過該親筆信公開後不到3小時便被刪除,但已在網路上廣泛流傳。消息曝光後,韓媒也立即向Dara方面求證。朴春(左二)公開信件並點名團員Dara(左一)與CL(右二),相關內容引發粉絲討論。(圖/達志/美聯社)對此,Dara所屬經紀公司ABYSS Company表示,由於與Dara的合約已經結束,因此難以確認相關情況。不過據韓媒《Xports News》報導,Dara身邊人士否認相關指控,表示「完全不是事實」,並透露Dara反而對朴春目前的健康狀況感到擔心。朴春近年因健康問題減少演藝活動,此次社群發文事件曝光後,再度引發韓國網友與粉絲關注。CTWANT關心您: 勇敢求救並非弱者,您的痛苦有人願意傾聽,請撥打1995 如果您覺得痛苦、似乎沒有出路,您並不孤單,請撥打1925 珍惜生命拒絕毒品,健康無價不容毒噬。

「廉價版瘦瘦針」沒了!美FDA揚言移送司法部 醫療公司緊急踩煞車
美國遠距醫療公司Hims & Hers近日宣布,將下架其推出不久的仿製版減重藥丸。該產品因價格低廉、成分與知名減重藥Wegovy(俗稱瘦瘦針)相同,引發藥界爭議,並接連遭到製藥大廠與監管機構的法律行動警告,最終促使公司緊急踩煞車。CNBC報導,Hims& Hers於週六透過社群媒體表示,自推出含有司美格魯肽(semaglutide)的複方減重藥丸後,已與產業多方利害關係人展開溝通,並在綜合考量後,決定停止提供該項治療服務。公司強調,未來仍將致力於為美國民眾提供安全、可負擔且個人化的醫療照護。據了解,該款藥丸原被視為製藥巨頭諾和諾德(Novo Nordisk)旗下明星減重藥Wegovy的平價替代品,主打相同活性成分司美格魯肽,首月價格最低僅49美元(約新台幣1500元),較原廠藥價格便宜約百美元,迅速引起市場關注。然而,諾和諾德隨即警告,Hims & Hers涉嫌「非法大規模複方製造」,並表示將採取法律與監管行動。隔日,美國食品藥物管理局(FDA)也加入行列,宣布計畫對該藥物採取法律措施,包括限制相關原料的取得,並將案件移送司法部,讓爭議進一步升高。面對多方壓力,Hims & Hers回應指出,公司一向遵循法律規範,並以消費者安全與利益為首要考量。

瘦瘦針大規模訴訟!數千人副作用含胃麻痺、胰臟炎 已17死
近年來「瘦瘦針」風靡市場,成為不少人眼中的快速瘦身神器,但家醫科醫師王姿允分享,自2023年以來,已有4400名患者對藥品生產商提起訴訟,指控內容涵蓋嚴重胃腸問題、營養不良併發症、神經與血栓疾病等,英國也出現逾千例胰臟炎報告,包括17例死亡案例,讓她忍不住感嘆,「所以一個會讓人噁心嘔吐吃不下喝不下的藥物,我真心會怕!」王姿允4日在臉書粉專發文表示,她前一天與美國醫師討論關於「瘦瘦針」副作用的訴訟,隨著使用猛健樂的美國人數量上升,起訴製造商的人數也在增加,根據《今日美國》報導,自2023年以來,已有4400名患者對藥品生產商提起訴訟,原告的年齡從18歲到87歲不等。王姿允指出,目前減肥藥物訴訟在美國多個州進行聯合訴訟,其中律師團提出的傷害包括以下10種:1、胃腸道嚴重問題75%的人主張出現胃麻痺(gastroparesis)的狀況,表現為嚴重延緩胃排空,有人被診斷為嚴重或永久性胃麻痺或胃輕癱(stomach paralysis or gastroparesis)。還有人腸阻塞或腸梗塞,部分人需要接受手術,還有人結腸破裂。另有8%的人因嚴重嘔吐到需要住院治療,還有人因噁心、嘔吐、腹瀉、便秘或其他胃腸道問題,需要住院或多次就醫。2、眼睛與神經相關問題例如突發性視力喪失、新的色盲或眼部血流中斷(NAION)、視神經喪失等。 3、深靜脈血栓或肺栓塞,有死亡案例。4、肝腸道外傷或需要手術。5、營養不良併發症。6、壞死性胰臟炎。7、需要手術的咽部損傷。8、術中肺吸入。9、2022年3月之前發生膽囊損傷,導致膽囊切除。10、胰腺癌。王姿允提到,與此同時,英國也警示,目前已出現超過千例的胰臟炎報告,包括17例的死亡個案。王姿允說,製藥公司(如Novo Nordisk和Eli Lilly)堅稱,這些藥物都已經過嚴格測試與FDA審查,並明確標籤說明已知風險(如胃腸不適),在許多臨床試驗與大規模觀察性研究中,安全性整體被認為是良好。而有些受害者指控,仿單並未「強調死亡風險」,許多開立的醫師也並未讓他們了解到這些風險。王姿允認為,民眾心存僥倖,加上醫師淡化風險跟安全性保證,就是這些悲劇發生的原因;對藥廠而言,他們的工作只有砸錢研發跟做研究,以及用研究結果申請藥證,只負責把可能的副作用列出,並不負責民眾的心態和醫師的話術,雖然在判決結果下來前,很難說明到底是「減重」的副作用,還是「藥物本身導致」,但一般無藥物飲食減重沒有強迫胃延遲排空的副作用,也不擔心會脫水。王姿允強調,胰臟炎、膽結石、胃腸副作用、吸入性肺炎,都與「強迫吃不下、喝不下」有強烈關聯,這就是她為什麼堅持不用藥物,因為在她的認知裡,減重需要吃的食物跟水量都很大,而「減掉大體重」本身就伴隨流失肌肉跟脫水的風險,「所以一個會讓人噁心嘔吐吃不下喝不下的藥物,我真心會怕!」王姿允說,如果這些訴訟後續真的判賠,對藥廠來說會是相當大的重創,她建議開藥醫師應將副作用跟風險說清楚,開藥的劑量和時間越短越好,民眾把癮戒掉後,就趕緊用健康的飲食和生活型態維持已瘦下的體重,或繼續往目標前進。
備孕、懷孕期間感冒怎麼辦? 婦產醫解答「3常見疑問」:用藥需注意
許多女性或媽媽在備孕或懷孕時不小心感冒,總擔心吃藥或打針會影響備孕進度以及胎兒發展,因而寧可不就醫治療,或即使治療也不願意按時服藥,小心若症狀嚴重,反而危及健康,不過究竟備孕及懷孕期間不小心感冒時,該如何應對?感冒藥真的不會影響胎兒健康嗎?又是否有其他舒緩方式可以緩解症狀呢?婦產科醫師王儷璇透過文章帶你一一一破解迷思,陪你一起迎接寶寶到來!備孕和懷孕期間感冒,怎麼辦?王儷璇表示,無論是備孕或懷孕期間不小心感冒,必要時都可第一時間主動告知醫師,除了給予用藥建議,也能提供日常居家照護的衛教資訊,讓備孕女性及媽媽們能夠安心。備孕、備孕期間感冒,注意3件事!1.建議掛婦產科,就醫時主動告知:無論是備孕中或懷孕期間,若出現相關症狀,建議可以直接尋求婦產科醫師的協助,原因在於婦產科醫師較熟悉孕期安全用藥分級,也能同步檢查胎兒的健康,以確保感冒是否有影響宮縮或胎動異常。2.避免亂服藥或購買成藥吃:王儷璇指出,無論是懷孕或備孕期間感冒在所難免,並非不能吃藥,而是要別亂用藥,若出現發燒的症狀,也不代表是感冒惡化,但是不建議「常規使用」退燒藥,因為退燒藥可能會延長病程,建議透過醫師專業指導,進行安全用藥。3.留意重症徵兆:懷孕期間免疫力較低,因此,也別輕忽任何小感冒,若出現呼吸困難、持續高燒、胎動異常等情況時,應盡快就醫檢查。▲【圖/衛生福利部國民健康署孕產兒關懷網站】懷孕、備孕用藥5等級 守護母嬰健康這樣做王儷璇指出,許多女性在懷孕時,面對病毒的來勢洶洶,寧可自己受苦也不要胎兒受到影響,事實上,只要尋求專業的醫師協助,並且了解用藥安全的重要性,不僅能夠幫助自己減緩症狀的不適,也能守住胎兒健康,根據FDA(美國食品藥物管理局 )針對懷孕用藥分為五個等級如下:A級:在針對孕婦的研究中,尚未證明在懷孕初期對胎兒有風險。B級:在針對動物的實驗研究中,並未證明對胎兒有風險。C級:在對動物的實驗中,可能對胚胎產生風險,但尚無人體實驗,而該藥物的潛在益處可能大於風險。D級:針對孕婦的研究顯示,藥物對於孕婦、胎兒存在危害。X級:禁用,研究顯示對於胎兒、孕婦皆存在風險,而且危害大於風險。關於備孕及懷孕時感冒,常見3個疑問一次解析! Q.若服用了感冒藥才發現懷孕怎麼辦?王儷璇解釋,其實女性和媽媽們不用過於擔心,一般而言,多數常見感冒藥對於生理以及胎兒健康影響不大,不過建議再回診時可保留藥單提供給婦產科醫師作爲參考及評估。Q.除了透過飲食、補充保健品,還能如何增加保護力?預防勝於治療,完整接種疫苗是降低感染後重症風險的關鍵,包括每年定期接種流感疫苗、準媽媽在懷孕28至36週時建議接種百日咳疫苗,另外也可維持新冠疫苗追加劑的更新等,以降低重症風險。Q.懷孕時感染流感,可能更嚴重嗎?是的,孕婦是流感的高危險族群之一,其中,研究也顯示,孕婦感染流感的重症風險是一般人的4至5倍,主要因懷孕期間生理機能、免疫系統等改變,會讓風險比一般人顯著增加,因此平時應做好防護工作(包括接種疫苗),若出現發燒、呼吸困難等症狀時,應立即就醫。王儷璇也提到,懷孕會引發顯著的心肺與免疫系統變化,包括心率增加、肺容積減少以及免疫反應的改變,這些變化提高了發生嚴重流感後果的易感性,例如:住院、入住加護病房 (ICU)、呼吸衰竭及死亡。 備孕和懷孕期間感冒必5大的居家照護!1.持續補充營養素:無論備孕或懷孕期間最重要就是維持良好的生理環境以及胎兒生長環境,因此應持續補充葉酸、維生素D等營養素,維持免疫力。2.呼吸道以及喉嚨照護:像善用生理食鹽水洗鼻,減輕鼻塞等不適症狀,睡覺時也可墊高枕頭,減少鼻涕倒流引發的夜間咳嗽;另外也可使用溫鹽水漱口,降低喉嚨發炎反應,並保持室內一定濕度,減少氣管敏感的機率。3.多補充水分:建議每天飲用2000c.c.以上的溫水,並以少量多次補充,但若本身心臟、腎臟有問題,建議尋求專業的醫師或營養師。4.維持充足睡眠:睡眠對於抵抗病毒、維持免疫力也有幫助,建議每日可保持 7至9小時睡眠較佳。5.清淡且均衡飲食:王儷璇提醒,建議以「原型食物」作為日常飲食原則,包括鮭魚、鱈魚、牛奶、豆漿等蛋白質飲食,搭配富含天然維生素C的芭樂、奇異果以及蔬菜等,以維持體能補充。資料來源:臺灣大學醫學院附設醫院-衛教資料Pregnancy Medications

微波爐加熱「不是放中間」!藥師曝正確位置揭原理:不會致癌
微波爐已成為家庭常見家電,不少民眾加熱食物時習慣將餐點置於正中央,不過藥師何峻宇近日於影片中指出,若為一般家中常見的轉盤式微波爐,食物位置應放在邊緣才能提升加熱效率,引發許多網友討論。何峻宇在YouTube影片中先澄清微波爐相關疑慮。他表示,微波爐透過電磁波使食物中的水分子振動並產生熱能,此原理屬於「非游離型輻射」,不會對人體造成致癌風險。他進一步提到,相較於煎、炸等高溫料理方式,微波加熱能降低營養素流失,甚至有機會比水煮更能保留食材原味。何峻宇說明微波爐不會致癌。(圖/翻攝YouTube/三寶藥師)影片中最受關注的則是「加熱位置」。他說明,轉盤式微波爐的微波通常從側邊發射,將餐點放在盤面邊緣,隨轉動即可使食物不同部位接收到較均勻的能量,達到較佳加熱效果;若使用超商常見的平台式微波爐,因為微波從底部釋放,將食物放在中央才是正確作法。此內容曝光後,網路上出現兩種反應。部分網友表示恍然大悟,「難怪中間常常冰冰的」、「原來我誤會它這麼多年」;另一部分網友則提到實際操作不易,「盤子太大放邊邊會卡住轉不動啊」、「放邊緣感覺轉一轉會飛出去,強迫症只能放中間」。此外,粉絲專頁「約翰家庭百貨」也曾分享相同觀點,建議轉盤式微波爐的食物放於邊緣位置,使其在旋轉過程中更均勻受熱;至於無轉盤的機型,由於微波從底部釋放,加熱分布較為一致,可在加熱中段暫停一次,翻動或攪拌內容物,以提升整體受熱效果。針對微波爐是否會造成輻射疑慮,國健署先前則在公告中指出,微波爐是利用電磁波穿透絕緣體,讓食物中的水分子吸收能量後產生加熱效果,並非經由X射線或伽馬射線加熱,因此不會造成食物具有放射性。國健署也引用「美國癌症協會(ACS)」資料說明微波不會改變食物的化學性質,並引用「美國食品藥物管理局(FDA)」資訊補充,微波加熱過程反而可能保留更多維生素與礦物質。

白色巨塔2/被封神「2026年度好醫生」! 中榮神外科主任讓無照廠商執刀手術
台中榮民總醫院神經外科內的3名醫師,科主任鄭文郁、科主任楊孟寅、醫師廖致翔被爆料指出,放任無醫護人員執照的醫材廠商進入手術房內執刀手術,自己在旁納涼,3人讓無照廠商執刀至少已長達3年,粗估至少已有180名病人在不知情情況下,被「變更」主刀醫師。諷刺的是,3人中的科主任楊孟寅2025年12月30日被康健雜誌評選為「2026年度好醫生」、網紅醫師廖致翔更是對外主打「脊椎手術是吃飯的技能」。康健雜誌於2025年12月30日的報導中,指出台中榮總神經外科的科主任楊孟寅是「2026年度好醫生」,是台灣少數能將尖端科技轉化為臨床應用的「跨領域醫師」,將腦部、脊椎手術精準度推向極致,甚至領先全球取得美國FDA認證,將AR擴增實境導入困難手術,更長年穿梭於醫學中心與偏鄉醫院間,支援專業醫療支援不足的偏鄉地區。然而這樣的「好醫師」卻被爆料指出,其2025年執刀脊椎內視鏡微創手術時,竟在手術台上偷懶,反讓無醫護人員資格的醫材廠商,上桌(table)執行內視鏡手術,自己則在一旁觀看廠商執刀,相當離譜。台中榮總神經外科科主任楊孟寅放任無照廠商上手術台執刀,自己則在一旁納涼觀看,甚至還問病人「會痛要講」。(圖/民眾提供)不過這也並非楊孟寅第一次傳出醜聞,2011年間,台中檢警偵辦醫師協助病患詐領2800萬餘元的保險金案中,發現6名醫師參與其中,其中5人認罪,最終以捐款與義診換取緩起訴處分,而認罪的5人中就包含楊孟寅。判決書指出,保險掮客劉育仁勾結台中榮總醫生楊孟寅、中國醫藥大學附屬醫院醫生莊皓宇、陳春忠、李漢忠、沙鹿童綜合醫院醫生金若屏、李明鍾6人。其中楊孟寅在明知病患未到診的情況下,仍依照劉育仁之口述,開設殘廢或失能診斷書,於診斷書中勾選「病患親自到診」,登載「雙下肢癱瘓」、「輪椅代步」、「日常生活活動需要他人扶助」、「左右下肢肌力均1分」、「第4級中重度失能」等不實內容,共計協助4名病患填寫不實內容,詐得200萬餘元之保險金。廖致翔遭內部檢舉後,在臉書上大吐苦水,「有人投訴老廖違反醫療倫理和醫院規範...老廖是個窮兇惡極、不顧患者的醫師,千萬不要來找老廖診治哦!」(圖/翻攝自廖致翔臉書)而醫師廖致翔經營自媒體有成,在網路上擁有5.6萬名粉絲追蹤,於中榮官網的醫師自介欄中表示,「腦部手術最高!脊椎手術是吃飯的技能」,專攻腦部腫瘤、脊椎退化手術、脊椎腫瘤與脊椎外傷,並在2018年參與「神經外科青年醫生手術技能大賽」,以「左顳葉內側腫瘤」手術案例,擊敗全球各路好手,獲得膠質瘤組總冠軍。儘管獲得手術技能大賽總冠軍,廖致翔卻在2025年底遭台中榮總內部檢舉,指出廖致翔放任廠商上table執刀進行內視鏡手術,更加諷刺的是,知情人士指出,廖致翔遭檢舉後短時間內不敢再讓廠商上table,改由自己執刀,卻疑似因技術生疏,不慎用壞廠商器材。廖致翔2025年底遭醫院內部檢舉後,也疑似在臉書粉專上發洩情緒,發文表示,「有人投訴老廖違反醫療倫理和醫院規範,院方將老廖送至人評會懲處。老廖是個窮兇惡極、不顧患者的醫師,千萬不要來找老廖醫治哦!」,並在下方表示「等麻醉準備的手術前放鬆文」,引來不少支持者在下方加油打氣。3位醫師中,科主任鄭文郁除為台中榮總神經外科醫師外,也同時擔任台灣腦下垂體學會理事長;另,科主任楊孟寅也同時擔任台灣中青年神經外科醫學會常務理事。對此,台中榮總全盤否認廠商進手術室執刀。中榮公關室主任李萬國回應,有關神經外科讓外面廠商進駐開刀一案,經查本院沒有讓任何廠商從事任何醫療行為;針對神經外科廖致翔醫師遭內部檢舉放任廠商進入手術室執刀一事,本院再次重申,廠商沒有從事任何醫療行為,醫院對於目前廖致翔醫師違反手術室門禁管制作業指導書一案已經由政風室與人事室完成調查,目前移送考績會審議中,預計下周將會有結果出爐。

中國生物製藥全面挑戰美國主導地位!北京與上海恐成世界創新中心
中國生物製藥產業正站上關鍵轉折點。隨著研發實力與產業結構的成熟,這個全球第2大製藥市場已被視為進入「創新2.0」階段,從過往追求速度與規模的高速擴張,轉向以品質、價值與商業化能力為核心的發展模式。在部分關鍵領域,中國不僅已追上美國,甚至開始展現超車之勢。據《南華早報》報導,分析公司科睿唯安(Clarivate)於12月8日發布的報告指出,中國生物製藥產業正在經歷1場根本性的優先順序轉換,從資本驅動轉向價值導向,從追逐市場熱點轉向建立可持續競爭優勢。科睿唯安生命科學與醫療健康(Clarivate Life Sciences and Healthcare)資深顧問Alice Zeng指出,過去10年間,中國企業專注於如何進行研發,如今則必須正面迎接藥物上市後的現實問題,包括市場策略、定價能力與重磅藥物的打造。這種轉變發生之際,美國對中國生技能力的警戒也持續升高。美國國會多年來推動的《生物安全法案》(Biosecure Act),已於12月18日隨國防法案正式立法,授權行政部門限制與特定中國生物科技公司的聯邦合約往來。儘管法案未直接點名企業,但其長期影響,特別是在早期藥物研發與合作層面,仍被業界高度關注。然而,限制措施能否有效遏止中國的生物製藥崛起,正逐漸受到質疑。今年4月,美國兩黨立法委員會「新興生物科技國家安全委員會」(National Security Commission on Emerging Biotechnology)警告,美國僅剩3年時間維持或重奪生物科技領導地位,並於12月直言,美中差距縮小的速度「快於預期」。該委員會形容,1個以北京與上海取代舊金山與波士頓、成為全球生物製藥創新核心的世界,已不再只是想像。在實務層面,中國企業已在PD-1癌症藥物等領域展現競爭力。由上海君實生物(Shanghai Junshi Biosciences)研發的特瑞普利單抗(Toripalimab),於2023年獲美國食品藥物管理局(Food and Drug Administration,FDA)核准治療鼻咽癌,成為首款獲准對抗此類侵襲性癌症的藥物。即便在美國的售價遠高於中國,該藥仍比美國同類產品便宜約2成,突顯中國在成本與供應鏈上的優勢。數據同樣反映這股趨勢。2004年至2023年間,全球共推出942種新型活性物質,其中美國居首、中國緊隨其後。根據科睿唯安統計,中國已成為全球新分子實體(New molecular entity,NME)首次上市數量排名第2的國家,並在2024年占比達18%。在標靶蛋白質降解(targeted protein degradation,TPD)等前沿技術上,中國於論文發表、專利與研發管線的全球占比均居領先地位。支撐這一躍進的,還包括龐大的科研產出與政策配套。2024年,中國發表的生命科學論文占全球近3成,幾乎是9年前的2倍。官方推出的30天臨床試驗快速審批通道,以及串聯研發、融資、監管與健保的政策體系,進一步壓縮藥物上市時程,使中國的審批速度已與美國幾乎同步。這樣的環境,也吸引國際藥廠重新思考市場布局。越來越多企業選擇優先向中國國家藥品監督管理局(National Medical Products Administration,NMPA)申請上市,再進軍其他成熟市場。對於面臨激烈競爭與高成本壓力的企業而言,中國不僅是龐大的銷售市場,更可能成為全球化布局的起點。然而,低成本亦帶來結構性挑戰。Alice Zeng指出,中國來源藥物的價格優勢,正使印度、南韓等新興市場的競爭變得更加激烈,甚至可能壓縮全球創新生態的利潤空間。她警告,若創新藥物只能以最低價競爭,將難以支撐長期研發投資,反而削弱整體產業的可持續性。即便如此,多數觀察者認為,要在創新藥物研發上全面複製中國的生態系並不容易。從基礎研究到供應鏈整合,再到臨床試驗與市場規模,中國已形成高度完整的體系。正如美國新興生物科技國家安全委員會所言,中國在生物製藥創新上超越美國的世界,已不再是未來假設,而是1個正在成形的現實。
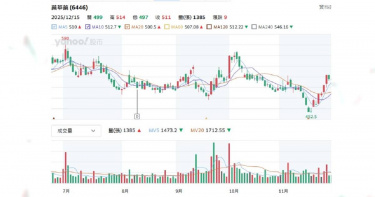
新藥股大漲跌1/這二檔營收利多股價亮眼 「它」納入中國目錄成亮點
台股力拼站回28K,AI概念股仍是主旋律,大數據分析等科技導入生技醫療產業也加速新藥研發進程,臨床試驗數據一翻兩瞪眼好壞在眼前,CTWANT調查2025年股價亮眼上漲與慘跌共四檔新藥股,2026年展望是個個有希望,最關鍵的還是營收財報給證據。 先來看看最新一例,2025年12月7日中國國家醫保局公布首版《商業健康保險創新藥品目錄》,納入18家企業19款高值創新藥,聚焦CAR-T、雙抗、罕見病及阿茲海默症等超出基本醫保範圍的產品,研發PTS肺癌新藥的共信-KY(6617)子公司天津紅日健達康醫藥科技公告「治療中央型氣道阻塞產品-PTS302」,成為台股唯一上榜個股,消息曝光,股價從78.8元上漲到86.6元,旋即又短暫下跌86.4元,再逐步漲到15日收盤價90.5元,到這周連四跌、周五收盤價85元。 CTWANT調查,共信12月3日公布11月合併營收259.1萬元,年減12.5%,累計雖年增11.42%,但投資人擔憂目錄效應需時間轉化實際訂單。 至2025年12月15日止,觀察仁新醫藥(6696)、藥華藥(6446)個股股價變化,其均以創新藥為核心,近期受臨床進展、營運利多驅動,股價有所表現。仁新醫藥近一月從270元上漲到最高442元,近三月則從162元漲到周五收盤407元;藥華藥近一月從453元漲到最高519元,近三月則最高漲到559元。仁新醫藥專注罕見疾病新藥,子公司Belite Bio(美國納斯達克BLTE)Tinlarebant三期臨床於2025年12月1日公布,針對青少年斯特格病變臨床三期試驗(DRAGON)解盲之關鍵性數據亮眼,共收案104位青少年受試者,並成功達成主要療效指標。Belite董事長暨執行長林雨新醫學博士表示,「DRAGON最終試驗結果讓斯特格病變疾病治療迎來了歷史性突破,Tinlarebant將成為首個治療這種具威脅性疾病的潛在新藥,期盼藉此帶給無藥可醫的患者及其家屬治療新希望。」BLTE股價從今年初低點62.09美元,漲到近期的最高點156美元,「三期解盲成最大催化劑。」證券分析師表示。Belite規劃於2026年上半年與各國監管機構討論Tinlarebant的潛在後續計畫與新藥查驗登記申請(NDA)送件事宜,並向美國FDA遞交新藥查驗登記申請(NDA)。Belite宣布Tinlarebant抑制視網膜萎縮進展達預期,股價飆至新高,仁新持股 43.94%間接受惠,募資126億元不折價增資當日完成。仁新2026年關鍵為Tinlarebant FDA核准,預計上半年送NDA。藥華藥向美國FDA申請Ropeg新適應症「原發性血小板過多症(ET)」,目標2026上半年取證。圖左起為執行長林國鐘、董事長詹青柳、總經理黃正谷。(圖/CTWANT資料照)藥華藥旗下真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(Ropeg,P1101)用於新適應症罕病血癌藥銷售勁揚,股價高檔震盪,10月底完成向美國FDA申請Ropeg新適應症「原發性血小板過多症(ET)」送件,若順利獲准,最快有望於2026年上半年取得美國ET藥證,成為公司啟動第二成長曲線的重要動能。藥華藥11月營收15.5億元,月增10.63%,年增53.02%,已連續3個月刷新單月歷史新高;累計前11個月達137.11億元,較去年同期的86.02億元,成長59.38%;前三季獲利達35.69億元,年增翻倍,每股盈餘9.66元,賺近一個股本。根據CTWANT調查,藥華藥也正同時研發新款癌症藥物。此外,Ropeg筆型注射劑的補充性生物製劑查驗登記申請(sBLA)審查亦同步進行中。FDA已通知審查目標完成日(PDUFA date)為2026年2月14日。

多吃魚變聰明?譚敦慈「最推薦這種魚」 少吃4種大型魚類
魚類富含DHA與EPA等成分,具有預防心血管疾病與降低失智風險的功效。衛福部指出,魚類與海鮮不僅脂肪含量低,還含有豐富的ω-3(Omega-3)脂肪酸,有助於減少身體發炎反應。對此,有「無毒教母」之稱的譚敦慈也分享自身選購魚類的原則,特別推薦鯖魚,同時提醒民眾要少吃四種特定魚類。譚敦慈日前在節目《健康2.0》中表示,國外曾有研究指出某地區孩童的智商普遍偏低,雖然他們同樣以魚類為主食,但主因可能與他們多食用大型魚種有關。譚敦慈強調,大型魚體內可能積存較多重金屬或污染物,長期食用恐影響健康,並點名鮪魚、旗魚、油魚與鯊魚這四類魚種應減少攝取。此外,從毒物學角度出發,譚敦慈提醒有「三不吃」原則:魚頭、魚皮與魚內臟,因這些部位較易累積毒素,應避免食用。談到如何「聰明吃魚」,她建議以小型魚為主,所謂小型魚是指能夠整條放入盤中、頭尾可見的魚種。她特別推薦鯖魚,因其魚油含量為所有魚類之冠。選購鯖魚時,應挑選肉質具彈性、無腥臭味且魚眼明亮者,同時避免魚體表面出現過多黏液。購買後也應盡量請商家現場處理內臟,以減緩腐敗速度。至於台灣人常見的虱目魚,譚敦慈指出其魚肉含有優質脂肪,但魚肚上的油脂並非Omega-3脂肪酸,而是一般脂肪,因此建議食用部位以魚肉為主,避免攝取過多魚肚脂肪。她補充指出,曾有病患為攝取「魚油」而大量食用虱目魚肚脂肪,結果膽固醇指數飆高。針對魚類選擇,環境部亦曾引用美國食品藥品管理局(FDA)的建議,提醒民眾避免攝取含汞量高的七種魚類,包括國王鯖魚(高汞品種)、旗魚、橙鯛魚(又稱長壽魚)、鯊魚、劍魚、墨西哥灣方頭魚與大眼金槍魚。相對而言,較為健康的魚種則包含藍魚、水牛魚、鯉魚、石斑魚、智利鱸魚、大比目魚、白色與黃色金槍魚、馬鮫魚、大西洋條紋鱸魚、太平洋黃花魚等,民眾可依自身需求與健康狀況選擇攝取

藥華藥再捷報!Ropeg完成申請美國ET藥證 拚2026取證
藥華藥(6446)再報佳績,11月營收再創新高之外,旗下新藥Ropeginterferon alfa-2b-njft(Ropeg,即P1101)於美國申請原發性血小板過多症(ET)新適應症藥證進展順利,已完成與美國食品藥物管理局(FDA)的送件說明會議(AOM),預計2026年取證。藥華藥於12月8日以視訊方式與FDA審查官員召開ET藥證申請之AOM,AOM(Application Orientation Meeting)為公司提交藥證申請後,與FDA審查官員團隊舉行的首次正式會議。會中,公司向FDA審查官員深入說明申請文件架構、臨床效益摘要、藥物機轉及安全性等重點。透過AOM,公司得以引導審查官員在龐大的臨床資料中聚焦關鍵數據,並協助FDA在啟動實質審查前即可掌握送件資料的核心脈絡。藥華藥11月營收15.5億元,月增10.63%,年增53.02%,已連續三個月刷新單月歷史新高。藥華藥2025年10月底向美國FDA申請Ropeg的ET藥證,並已獲FDA確認,若於收件日起60日內FDA未通知其他意見,本案將依法於2025年12月29日正式進入實質性審查程序。 Ropeg為藥華藥自行發明生產的新一代創新長效型干擾素,至今已獲全球約50個國家核准用於真性紅血球增多症(PV)患者並上市銷售,包括歐盟、美國及日本等主要新藥市場,全球用藥人數及銷售穩健成長。持續拓展Ropeg新適應症,ET與PV同屬骨髓增生性腫瘤(MPN),病人數亦相近。

全台首宗化妝品驗出蘇丹紅!食藥署公佈14業者名單 要求問題產品48小時內下架
國內首件化粧品檢出蘇丹紅!食藥署今公布,本月12日接獲綠藤生物科技主動通報,旗下產品疑似檢出蘇丹紅,17日也在網路平台發現中國卸妝膏含有蘇丹紅,並將其下架。今(21日)食藥署經國家實驗室確認,綠藤生機產品的確含有蘇丹紅,而其進口商「亦鴻企業有限公司」的原料,更流向14家業者,包含歐萊德、傑艾莉、彤采妮等,已要求業者48小時內下架、回收。今(21日)食藥署經國家實驗室確認,綠藤生機產品的確含有蘇丹紅,而其進口商「亦鴻企業有限公司」的原料,更流向14家業者,包含歐萊德、傑艾莉、彤采妮等,已要求業者48小時內下架、回收。圖為業者名單(圖/食藥署提供)食藥署副署長王德原說,今年10月底,食藥署監控到國際風險訊息,中國製造的化粧品使用到新加坡公司Campo Research( Campo Cosmetics) Pte. Ltd.公司所生產、疑似含有禁用色素蘇丹4號的原料。因此,食藥署在11月4日行文通知國內化粧品製造及輸入業者,要求全面檢視供應鏈原料來源,並加強自主管理。今年11月12日,食藥署接獲綠藤生物科技股份有限公司主動通報,其產品「專心護唇油-莓紅版」(批號: M25062702、M25073001、M25100701)疑檢出蘇丹4號(CI 26105),19日會同轄區衛生局赴原料進口商「亦鴻企業有限公司」稽查,當場扣查3批原料藥。國家實驗室於21日檢驗確認檢出蘇丹紅,濃度很高,但仍在定量中。為嚴防問題產品擴散,食藥署20日要求亦鴻企業有限公司提供下游廠商14家業者資訊,且要求48小時內完成清查,並回報使用狀況。未經確認安全前,相關產品一律不得上架販售。另為釐清是否尚有其他業者輸入新加坡Campo Research( Campo Cosmetics) Pte. Ltd.公司的問題原料,食藥署已於11月18日函請財政部關務署提供相關輸入報關資料,以利進一步追查。在這之前,食藥署也在momo平台所販售的小紅書知名產品進行抽驗,17日發現歐妮有限公司的「且初越桔清透卸妝膏(無花果味)」(批號:B5A1431)(產地:中國)檢出禁用色素蘇丹4號(CI 26105)1.3 ppm,已要求網路平台全面下架問題產品,並將販售業者歐尼公司移請所轄衛生局裁處,並呼籲消費者停用。食藥署說明,蘇丹4號(CI 26105)為化粧品禁用色素,依法不得添加於化粧品中。違規者涉違反《化粧品衛生安全管理法》第6條,依同法第22條,可處新台幣2萬元至500萬元罰鍰,並得按次處罰;不合規定產品依同法第16條至第18條,不得供應、販賣、贈送、公開陳列或提供消費者試用,並必須全面回收銷毀。民眾如購買到有疑慮產品,應停止使用並向廠商辦理退換貨;如出現皮膚紅腫或搔癢等不適,應立即洽詢皮膚科醫師。消費者在選購化粧品時,建議選擇來源清楚、合法登錄之商品,避免購買來路不明商品,以降低使用風險。若使用化粧品發生不良反應,可通報食藥署「藥品醫療器材食品化粧品上市後品質管理系統」,網址:http://qms.fda.gov.tw/tcbw/,通報專線:02-2521-5027。

藥華藥大漲22元、4.85%!新藥創美FDA近30年 「首件」申請ET藥證
台股20日強彈收在27,426.36點,大漲846.24點,漲幅達3.18%;台積電漲60元收在1455元。新藥股中的藥華藥(6446)在最新公布Ropeg應用於治療ET的全球第三期臨床試驗「SURPASS ET」成果,邀請到競爭對手Incyte前總座Barry Flannelly擔任美國子公司獨立董事,喊出目標營收10倍成長,激勵股價收在475.5元,漲22元,漲幅達4.85%。藥華藥旗下真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(簡稱Ropeg, 即P1101)用於新適應症「原發性血小板過多症」(ET)的全球藥證申請,繼陸續完成中國、臺灣、日本ET藥證申請,近期更於美國時間10月30日完成美國ET藥證申請送件,為近30年來業界首度向FDA申請ET藥證,創下ET領域新藥里程碑,目標2026年取證。FDA已發函通知,若自收件日起60日內FDA未通知其他意見,本案將依法於2025年12月29日正式進入實質性審查程序。藥華藥執行長林國鐘表示,這是近 30 年來業界首度向美國FDA申請ET藥證,非常珍貴。Ropeg用於治療ET的第三期臨床試驗結果已充分顯示Ropeg對ET病患極具顯著臨床效益。目前ET的主要用藥是愛治(HU)和ANA,但其療效與耐受性仍十分有限。Ropeg不僅具有優於現行治療潛力,更有望成為第一個獲FDA核准可同時治療PV和ET的藥物,滿足MPN領域的醫療迫切需求,領航MPN市場。此外,藥華藥19日公布Ropeg應用於治療ET的全球第三期臨床試驗「SURPASS ET」成果,董事長詹青柳、執行長林國鐘表示,SURPASS ET是一項開放性、多中心、隨機分配、有效藥物對照之臨床三期試驗,以比較Ropeg與安閣靈(Anagrelide, ANA)做為二線治療對於ET之療效、安全性與耐受性。本試驗療程共12個月,並以受試者第9個月及第12個月均有療效反應為主要療效指標。另一方面,SURPASS ET更採用了Ropeg的快速遞增劑量方案(250mcg-350mcg-500mcg),以更高的起始劑量施打Ropeg,並更快施打到目標劑量。研究結果顯示,Ropeg組在持久臨床反應率方面明顯優於使用ANA的對照組(42.9% vs. 6.0%;p=0.0001),達到統計上顯著意義,展現了明確的臨床優勢。該研究成果於2025年美國臨床腫瘤學會(ASCO)年會中進行口頭報告,榮獲「Best of ASCO」年度精選論文肯定,並入選歐洲血液學協會(EHA)年會六大頂尖摘要之一,於最高榮譽的主會場(Plenary Session)發表,令醫師們印象極為深刻。SURPASS ET成果更於今年11月登上國際三大權威期刊之一《The Lancet》的血液學子刊《The Lancet Haematology》,不僅代表Ropeg在血液腫瘤治療領域的臨床價值獲得學術領域的關鍵肯定,也將成為未來臨床應用與治療指引的重要依據,並進一步提升Ropeg在血液腫瘤領域的國際能見度與學術影響力,更有助於後續藥證申請的審查和全球市場的拓展。

諦醫生技以新一代ADC技術,敲開生技奧斯卡大門
近日,台灣生技界傳來一則振奮人心的消息:諦醫生技入圍了素有「生技界奧斯卡」之稱的世界 ADC 獎(12th WORLD ADC Awards)。這項提名不僅是諦醫生技的榮耀,更是對台灣新藥發展實力的一次重要肯定。諦醫生技創辦人,同時也是深耕免疫學界數十年的張子文博士,在「生活講堂」節目中與主持人高葳Stacy分享了這份喜悅,並深入淺出地揭開了ADC藥物的神秘面紗。什麼是 ADC?生技界的「聰明炸彈」「ADC,就是 Antibody-Drug Conjugate,抗體-藥物複合體。」張博士他用了一個生動的比喻:ADC 就像一枚「聰明炸彈」。A (Antibody / 抗體): 是一群具有精準導航系統的「轟炸機」。它們被設計成只會辨識並鎖定(Target)特定的癌細胞。D (Drug / 藥物): 則是極其強效、劇毒的小分子「炸彈」。這些炸彈本身沒有專一性,如果隨意投放,會傷及無辜(即健康的細胞),這就是傳統化療副作用巨大的原因。C (Conjugate / 複合體): 就是將「炸彈」精確地掛載到「轟炸機」上的技術。ADC 的核心理念,就是利用抗體的精準導航,將高效劇毒的藥物,專一性地帶到癌細胞所在地,從而精準擊殺癌細胞,同時最大限度地降低對正常細胞的傷害。劃時代的演進:「高掛載」且可攜帶「雙彈頭」ADC 的概念雖已存在逾百年,但早期技術並不成熟。張博士形容,早期的 ADC 轟炸機,有的掛了兩三顆炸彈,有的甚至沒掛好就起飛了,效果自然大打折扣。而諦醫生技的突破,正是在於開發出新一代的平台技術。張博士自豪地介紹了他們的兩大技術亮點:1.High-DAR (高藥物抗體比):傳統 ADC 轟炸機只能掛載 2 或 4 顆炸彈,而諦醫的技術可以穩定地掛載到 8 顆,甚至 12 顆。火力(藥效)顯著增強。2.Dual-Payload (雙彈頭):更關鍵的是,諦醫的平台能讓轟炸機同時攜帶兩種不同功能的炸彈。張博士比喻:「就像你到了目的地,有的炸彈要去炸引擎,有的要去炸油箱。」這種多重打擊,讓癌細胞更難逃脫。ADC領域之所以被視為當前新藥發展最熱絡的領域,正是因為大家都在競相開發「下一代」的技術。目前,ADC藥物在癌症等領域,都展現了比傳統化療高出許多的「反應率」(Response Rate)。更令人振奮的是,諦醫生技目前在動物模型實驗中發現,他們的 ADC 藥物對於那些已經產生「抗藥性」(Resistance)的癌細胞,依然展現出良好的效果。這意味著,對於那些使用現有藥物已無效的病患,諦醫的研發帶來了新的希望。一位科學家的「退而不休」對研發熱情永不熄滅談及這項入圍,張博士雖謙虛地表示這只是「很有鼓勵性」,真正的成就仍是將藥物成功推上臨床。但主持人也好奇,為何選擇在屆退之齡(2014年)再次投身艱苦的創業之路?張博士眼中閃爍著光芒。他提到,2011至2015年間,有三個沉寂了二三十年的免疫學相關領域——免疫查核點抑制劑、CAR-T,以及 ADC——突然間「開花結果」。「做為一個研究了幾十年(自 1975 年起)的免疫學家,突然在那個時間點,有這些東西出來了... 讓我非常振奮。」這股興奮激發了他的新發明,包括用以開發ADC的「藥物束平台」(Drug Bundles)。而他人生中最有滿足感的經歷,莫過於前一次創業(TANOX),耗時 16、17 年開發出治療哮喘和過敏的藥物 Xolair。那種「藥物最終可以治療很嚴重病人」的滿足感,驅使他再次投身新藥開發。諦醫的願景:打造「世界級的藥物」新藥研發是一條動輒10年、15年的漫漫長路。張博士強調,諦醫在選擇研發項目時,標準極高:必須有顯著療效差異、藥理機制必須扎實、必須有專利保護,且必須能生產。他們更要「勇敢」地做出「Go/No-Go」的決定,絕不拖延失敗的項目。張博士坦言,台灣有數百家生技公司,但真正被美國FDA核准為「新化學實體」(NCE)的藥物,至今只有兩件。而他的目標,就是帶領諦醫生技「發展出至少一個,或兩三個世界級的藥物」。「如果你的藥物是世界級的,這個公司就可以說是一個世界級的生技公司。」目前,諦醫生技正穩健地朝著上市(櫃)的目標前行。如同張博士在訪問中提到的,新藥研發不僅是為了讓病患「活下去」,更是為了讓他們「好好的活下去」,減少治療過程的痛苦與副作用。這次的世界ADC獎入圍,是國際對諦醫生技創新技術的認可,也是一個重要的里程碑。我們期待這家由擁有50年研發經驗的資深科學家所領軍的台灣公司,能持續在癌症治療的尖端領域,為全世界病患帶來更美好的未來。

疑未標示小麥恐致過敏!哈根達斯召回黑巧克力冰淇淋棒
美國知名冰淇淋品牌哈根達斯(Häagen-Dazs)近日因潛在過敏風險,宣布召回部分批次的黑巧克力迷你冰淇淋棒。生產商醉爾斯冰淇淋公司(Dreyer’s Grand Ice Cream, Inc.)指出,這些產品可能含有未標示的小麥成分,對小麥過敏或高度敏感者可能造成嚴重甚至危及生命的反應。據美國美國食品藥物管理局(U.S. Food and Drug Administration,FDA)公告,受影響產品為「哈根達斯黑巧克力迷你冰淇淋棒」(Häagen-Dazs Dark Chocolate Mini Bars),6入裝,批號為LLA519501,有效期限至2027年1月31日。醉爾斯公司追蹤後發現,該批產品曾於多州的克羅格(Kroger)及巨鷹超市(Giant Eagle)銷售。克羅格門市涵蓋全美29州,包括加州、德州、伊利諾、俄亥俄與華盛頓等;巨鷹則分布於印第安納、馬里蘭、俄亥俄、賓夕法尼亞及西維吉尼亞五州。公司與FDA合作進行召回,並強調其他哈根達斯產品或批次並未受到影響。醉爾斯在聲明中表示,問題可能出現在生產初期,「含小麥的原料被誤封入錯誤包裝」,導致標籤上未顯示小麥成分。該公司正持續進行內部調查,以釐清製程問題。截至11月4日,尚未接獲任何疾病或過敏反應通報。醉爾斯強調:「產品的安全、品質與完整性是我們的首要任務,對於造成的不便,我們深表歉意。」當局呼籲所有對小麥過敏或敏感的消費者切勿食用此產品,應立即丟棄,或退回原購買商店以獲全額退款。

大陸製藥實力匹敵歐美? 美媒:成貿易戰武器
美陸達成1年休戰協議後,雙方貿易角力並未止歇。美媒指出,在稀土與農業外,北京手中仍握有一項「尚未使用的武器」,也就是全球藥品供應鏈,因為大陸製藥實力現已匹敵歐美。專家警告,若陸美再陷對立,北京可藉切斷藥品與原料出口施壓,而美國已「完全喪失獨立生產抗生素的能力」,對陸依賴已構成潛在風險。文中稱,大陸製藥業在政府輔助下已完成產業升級,研發水準足以匹敵歐美,從基本的抗生素到先進製劑,皆具備相當競爭力。哥倫比亞大學學者費希曼指出,開放式貿易體系「並非為當前的地緣政治競爭而設」,卻正讓大陸得以引進外國技術逐步取代西方製造商。反觀美國,有專家警告美國已「完全喪失獨立生產抗生素的能力」。《中國處方》作者吉布森直言,由於大量生產環節轉移到海外,美國製藥整體產能已大幅流失。此外,美國食品藥物管理局(FDA)在國內進行突擊檢查,但在大陸需事先通知,且簽證程序繁瑣,讓大陸藥廠可提前準備、規避稽查。美國參院老齡問題特別委員會指出,美國藥品自製比例自2002年的83%降至2024年的37%。同時,30%的藥品活性成分完全依賴大陸供應;若計入印度生產、但使用大陸原料的藥物,比例更高達60%。美國外交關係委員會研究員黃嚴忠表示,美國製藥要恢復完整供應鏈「幾乎不可能」。大陸已建立大型產業園區,能以低運輸成本提供一站式原料採購與中間體生產,形塑難以撼動的優勢。分析認為,若西方要在此領域與大陸抗衡,必須推動「生產導向」的合作戰略。日本已開始資助國內企業重啟藥物原料生產,並尋求產品能免稅輸入美國。若能形成「美日歐」供應聯盟,或可避免歐洲最後一家抗生素工廠外移大陸的慘劇重演。

Lisa愛牌慘了!泰國宏泰草本吸入劑「微生物含量超標」 當局全面召回
BLACKPINK成員Lisa的愛牌、泰國知名草本品牌「宏泰」(Hong Thai)近日爆出產品安全風波。泰國食品藥物管理局(FDA)在例行檢查中,發現「宏泰草本吸入劑2號配方」(Hong Thai Herbal Inhaler Formula 2)第000332批次微生物含量超出安全標準,隨即要求全面召回。生產商「泰國宏泰有限公司」(Thai Herbal Hong Thai Ltd.)已承認檢測結果並展開回收與銷毀作業。綜合外媒報導,宏泰公司創辦人拉布亞湯(Teerapong Rabueathum)指出,問題僅限於2024年12月生產的該批次,其他批次產品安全無虞。他強調,外界傳言公司全面停產並不屬實。公司正與FDA合作,預計於2025年11月4日銷毀回收產品,並於會後召開記者會說明。宏泰公司表示,已加強製程控管,新增紫外線(UV)殺菌環節,確保未來產品符合衛生標準。公司亦開放全額退貨與換新服務,並向消費者與經銷商致歉。然而,就在宏泰召回事件曝光後,泰國警方與FDA聯合行動,於2025年10月30日破獲多處非法地下工廠,查獲大量假冒「宏泰」等品牌的草本吸入劑與藥膏產品,數量超過235萬件、價值逾1億泰銖。警方調查發現,這些產品雖以宏泰品牌名義銷售,但實際上是在未經FDA許可的地下工廠製造,品質與安全均未達標。泰國消費者保護警察局(CIB)指出,這些非法產品可能含有細菌污染,若吸入恐導致支氣管炎或肺炎。相關嫌疑人與查獲物品已移交警方偵辦。
露得清卸妝濕巾疑遭細菌污染 在美召回1.5萬包產品
美國食品藥物管理局(FDA)近日宣布,知名護膚用品大廠露得清(Neutrogena)旗下「超柔卸妝濕巾」(Neutrogena Makeup Remover Ultra-Soft Cleansing Towelettes),發生「格氏多元桿菌」(Pluralibacter gergoviae)污染事件,已經在美國展開召回。綜合外媒報導,美國食品藥物管理局近日發布公告指出,露得清母公司「Kenvue」在對部分產品進行格氏多元桿菌檢驗時,結果呈現陽性反應。這種細菌對添加在化妝品裡的抗菌劑「對羥基苯甲酸酯」具有抗藥性。FDA指出,格氏多元桿菌對一般民眾威脅不大,但對免疫力低下或慢性病患者,可能導致眼部、泌尿道感染或是呼吸道疾病,甚至引發敗血症。事件曝光後,母公司「Kenvue」已依照FDA的指示對美國境內展開產品召回。據了解,被召回的產品批號為「1835U6325A」,被銷售到德州、南卡羅萊納州、喬治亞州和佛州。目前,產品污染來源尚未確定,也並未傳出有相關病例通報,不過Kenvue發言人指出:「消費者健康與安全是我們的首要考量,儘管產品符合出廠規格,但基於謹慎原則主動召回。」發言人同時強調,其他露得清產品均未受到影響。據了解,這款卸妝濕巾在台灣好市多也有販售,不過除產品批號「1835U6325A」以外均非召回對象。

WHO警告:印度3款止咳糖漿受污染!釀21名孩童死亡
世界衛生組織(World Health Organization,WHO)於美東時間13日發布健康警示,提醒全球關注在印度發現的3款受污染止咳糖漿,並敦促各國當局若發現這些藥品應立即向WHO通報。據《路透社》報導,WHO指出,受影響的止咳糖漿包括Sresan Pharmaceutical的「Coldrif」、Rednex Pharmaceuticals的「Respifresh TR」,以及Shape Pharma的「ReLife」特定批次。WHO表示,這些受污染的藥品具有重大風險,可能導致嚴重甚至危及生命的疾病。印度藥品監管機構「中央藥品標準控制組織」(Central Drugs Standard Control Organization,CDSCO)告知WHO,這些糖漿曾被印度中央邦(Madhya Pradesh)欽德瓦拉市(Chhindwara)年齡不滿5歲的21名兒童服用,而這些孩子近期已不幸身亡。經檢測,該止咳藥中含有有毒的有機化合物「二甘醇」(diethylene glycol),含量幾乎是允許上限的500倍。CDSCO表示,這些受污染藥品尚未出口印度,也沒有非法出口的證據。此前,美國食品藥物管理局(U.S. Food and Drug Administration,FDA)也於10日確認,這些含毒止咳糖漿並未運往美國。

第四度!唐獎得主再奪諾貝爾獎 展現全球學術領航地位
諾貝爾化學獎8日公布得主,由唐獎第六屆「永續發展獎」得主奧馬爾.亞基(Omar M. Yaghi)與京都大學北川進(Susumu Kitagawa)、墨爾本大學理查.羅布森(Richard Robson)三人共同獲獎,表彰其在金屬有機框架(MOFs)領域的開創性貢獻。這是唐獎得主第四度再獲諾貝爾殊榮,繼2014年唐獎生技醫藥獎得主詹姆斯.艾利森與本庶佑、2016年得主伊曼紐.夏彭提耶與珍妮佛.道納,以及2022年得主卡塔林.卡里科與德魯.魏斯曼分別於2018、2020與2023年陸續榮獲諾貝爾獎後,再次展現唐獎得主在全球學術領域的領航地位。唐獎教育基金會執行長陳振川第一時間代表基金會與創辦人尹衍樑博士向亞基教授致賀,感謝唐獎評選委員會以獨立專業與前瞻視野,發掘對世界具有深遠影響力的科學家。亞基教授於2024年來台參與唐獎頒獎典禮、得獎人演講、大師論壇與青年對談等活動,並在基金會安排下前往台積電與工研院參訪,與產學界深入交流。奧馬爾.亞基現任加州大學柏克萊分校化學系詹姆斯與內爾蒂崔特講座教授、柏克萊勞倫斯國家實驗室資深科學家及柏克萊全球科學學院首任主任,同時擔任巴卡學院共同主任與首席科學家,曾獲17國重要獎項並擁有60項美國專利。亞基教授創立的「網格化學(Reticular Chemistry)」開啟材料科學新篇章,透過創新合成方法,將有機與無機單元以強鍵結構組成穩固多孔結晶,形成金屬有機骨架(MOFs)與共價有機骨架(COFs)。這些具高度可設計性的材料可有效捕捉並利用二氧化碳、氫氣、甲烷及水等關鍵氣體,為能源、環境及水資源等永續挑戰提供革命性解方,對聯合國永續發展目標(SDGs)貢獻重大。在應用上,亞基教授帶領團隊將MOFs與COFs推向實用層面。其研發的MOFs容器可在常溫下將二氧化碳儲存量提升18倍,經修飾後更能從燃燒氣體中高效捕捉碳排,部分技術已在加拿大水泥廠導入使用。在甲烷儲存方面,MOFs容器在安全氣壓下可提升3倍儲存量;在氫氣儲存方面,MOFs與COFs能於77K與100大氣壓條件下安全保存12重量百分比的氫氣,為潔淨能源發展奠下重要基礎。面對全球缺水問題,亞基教授亦以MOFs材料開創「空氣取水」技術,只需一公斤MOF材料、藉日照即可從乾旱地區低濕空氣中凝聚出飲用水,其水質超越美國FDA與EPA標準。近年他更與通用電氣及新創公司合作,開發可攜式集水裝置,在沙漠地區每日能收集數百公升飲用水,實現「Water Independent」願景。他曾指出:「空氣中的含水量幾乎等於地表所有河流與湖泊淡水總量,若能運用科技取水,將能改變全球用水困境。」在2024年10月於新竹中學舉行的「青年對談」中,亞基教授以〈破曉之水:從渴求到思索的旅程〉為題,與230多位高中生面對面交流。他鼓勵青年勇於冒險、追尋熱情,並以自身經驗提醒:「非凡的事情往往源自平凡的開始。」他勉勵學子以正向態度超越環境侷限,從逆境中孕育創新,正如他以科學實踐永續的精神,為人類創造更具韌性的未來。

藥華藥9月營收再創新高 累計前三季衝破百億
藥華藥(6446)最新公告9月營收13.2億元,月增3.44%,年增41.34%。累計前三季營收107.5億元,年增61.14%,不僅首度突破百億,更已超越去年全年,刷新營運里程碑。公司表示,美國與日本子公司銷售團隊已完成擴編與培訓,預期第四季起逐步展現效益,更為明年營收注入新動能。9月營收主要來自罕見血癌新藥Ropeginterferon alfa-2b(簡稱Ropeg,即P1101),其中美國市場出貨針數再創新高,顯示對Ropeg需求增長。Ropeg目前已獲全球近50個國家核准用於真性紅血球增多症(PV)患者並上市銷售,今年底前亦可望再取得墨西哥藥證。新適應症方面,原發性血小板過多症(ET)的藥證申請正加速推進。今年已完成中國、台灣、及日本的送件。美國FDA同意藥華藥直接送件,公司將於第四季正式向美國申請,並爭取優先審查資格,如順利獲准,有望最快於明年上半年取得美國藥證;如以標準審查資格進行,美國藥證則落在明年下半年,公司正面看待ET開啟營運的第二成長引擎。Ropeg用於ET的第三期臨床試驗「SURPASS ET」數據即將刊登於國際知名血液學專刊《The Lancet Haematology》,由血液學權威 Dr. Ruben A. Mesa 擔任通訊作者。該研究持續獲國際高度重視與肯定,凸顯Ropeg在ET治療的臨床價值,並將成為後續藥證審查及臨床應用的重要依據。此成果繼今年於美國臨床腫瘤學會(ASCO)及歐洲血液學協會(EHA)發表後,亦將積極爭取在美國血液學年會(ASH)中報告,持續提升Ropeg在三大國際血液學術會議的能見度與影響力。藥華藥亦積極拓展多適應症布局,持續打造長期成長曲線。在骨髓增生性腫瘤(MPN)治療領域中,公司已啟動針對Ropeg用於治療早前期原發性骨髓纖維化(PMF)患者的全球第三期臨床試驗 HOPE-PMF,計畫於台灣、美國、日本、中國等多國同步進行,目標招募150名受試者。公司繼8月8日在日本完成首位受試者給藥後,10月1日在臺大醫院完成臺灣第一位受試者給藥,目前已有多位患者參與試驗,臨床進度穩步推進。